题目内容
11.若将H2,O2、N2的混合气体10g点燃,完全反应后生成9g水,则原混合气体中氧气质量[m(O2)]的取值范围为8g≤m(O2)<9g.分析 氢气中氧气中燃烧生成水;由题意,将H2,O2、N2的混合气体10g点燃,完全反应后生成9g水,剩余的1g气体可能是氮气,也可能是氮气和氢气的混合物,也可能是氮气和氧气的混合物,据此进行分析解答.
解答 解:设参加反应的氧气的质量为x
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
32 36
x 9g
$\frac{32}{36}=\frac{x}{9g}$ x=8g
将H2,O2、N2的混合气体10g点燃,完全反应后生成9g水,剩余的1g气体可能是氮气,也可能是氮气和氢气的混合物,也可能是氮气和氧气的混合物.则若剩余的气体是氮气或氮气和氢气的混合物,则氧气的质量为8g;若是氮气和氧气的混合物,则小于(8+1)g=9g.
故答案为:8g≤m(O2)<9g.
点评 本题难度不大,掌握利用化学方程式的简单计算、充分考虑剩余气体的组成成分是正确解答本题的关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
16.下列元素符号中,有三种意义的是( )
| A. | He | B. | H | C. | Cl | D. | N |
5.下列不属于缓慢氧化的是( )
| A. | 铁生锈 | B. | 植物的光合作用 | C. | 呼吸作用 | D. | 酒精燃烧 |
 如图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为39g.稀释浓H2SO4时,要将浓H2SO4慢慢沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌.如果不慎浓硫酸沾到衣服上或手上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液.量取浓硫酸时仰视读数,会导致结果偏大(偏大、偏小).
如图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为39g.稀释浓H2SO4时,要将浓H2SO4慢慢沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌.如果不慎浓硫酸沾到衣服上或手上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液.量取浓硫酸时仰视读数,会导致结果偏大(偏大、偏小).
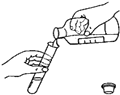 如图中,实验操作时各有三处错误,请指出并改正
如图中,实验操作时各有三处错误,请指出并改正
 ”表示氧原子,“
”表示氧原子,“ ”表示氢原子
”表示氢原子
