题目内容
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。

(1)实验开始前红墨水左右两端液面保持相平。容器I、II体积相同,装置气密性良好。
(2)实验a中,容器I内产生的现象是________.红墨水液面位置发生变化的原因________________________(用化学方程式表示)。
(3)实验b中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是________(填“I”或“II”),(4)红墨水的位置变化情况是_____。
【答案】
(1)石灰水变浑浊,产生白色沉淀(2)CO2+Ca(OH)2==CaCO3↓+H2O
(3)Ⅱ(4)开始时左高右低,最终左右相平
【解析】(1)实验a中,容器I中的物质为二氧化碳,从针筒中加入的物质是澄清石灰水,二者反应生成碳酸钙沉淀和水,所以现象为:石灰水变浑浊,产生白色沉淀。反应的化学方程式为:CO2+Ca(OH)2==CaCO3↓+H2O
(2)实验b中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡剧烈程度与金属的活动性有关。容器I中的金属为锌、容器II中的金属为镁;二者镁的活动性强。即容器II中产生气泡更剧烈。
开始时由于镁比锌反应快,因此容器II生成的气体快,红墨水左高右低。
0.24g镁与足量的稀盐酸反应可生成0.02gH2,0.65g锌与足量的稀盐酸反应可生成约0.02gH2;所以产生两容器最终生成气体的质量一样多。最终红墨水左右相平。
考点:二氧化碳的性质、金属与酸的反应
点评:根据二氧化碳与碳酸钙的反应、金属与酸反应的特点解题。

练习册系列答案
相关题目
为研究二氧化锰、加热对过氧化氢分解的影响,某同学设计了如下实验:
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如下图所示进行实验.仪器a的名称是__________,C中用于加热仪器的名称是_________.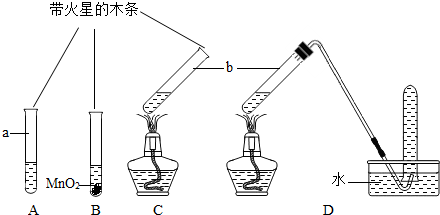 |
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. |
| 分析 | B试管中发生反应的化学方程式是______________. 实验结束后仪器b中的液体质量都减少,原因是_____________________ ________________________________________________________________. |
| 结论 | ①分析A、B实验可以得出的结论是:______________________________. ②加热__________(填“能”或“不能”)促进过氧化氢分解产生氢气. |


 SO2。已知集气瓶的容积为150mL,氧气的密度为1.4g/L,为了节约药品,理论上所取硫的质量不能超过多少克?(计算结果保留两位小数)
SO2。已知集气瓶的容积为150mL,氧气的密度为1.4g/L,为了节约药品,理论上所取硫的质量不能超过多少克?(计算结果保留两位小数)