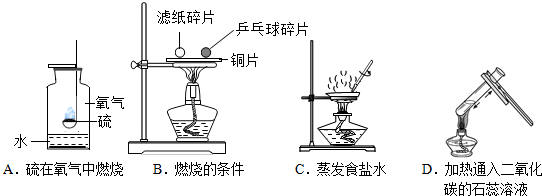
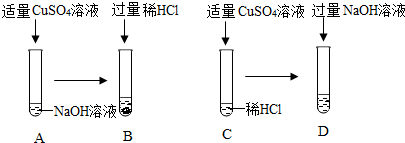
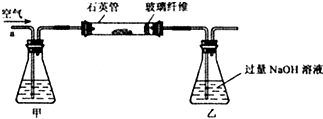
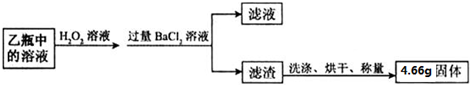
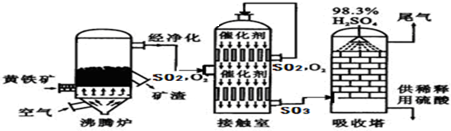
题目内容
2.现有某氧化铜、氢氧化铜和硫酸铜的混合物10克,与100克9.8%的稀硫酸恰好完全反应,则反应后所得溶液中溶质的质量可能为( )| A. | 10克 | B. | 8克 | C. | 17克 | D. | 16克 |
分析 根据已有的知识进行,氧化铜、氢氧化铜反应生成硫酸铜,硫酸铜与硫酸不反应,根据硫酸的质量即可求出生成硫酸铜的质量.
解答 解:假如是氧化铜和硫酸铜的混合物
CuO+H2SO4=CuSO4+H2O,
80 98 160
8g 9.8g 16g
则原混合物中硫酸铜的质量为10g-8g=2g,则所得溶液中溶质的质量为18g,
假如是氢氧化铜和硫酸铜的混合物
Cu(OH)2+H2SO4=CuSO4+2H2O,
98 98 160
9.8g 9.8g 16g
则原混合物中硫酸铜的质量为10g-9.8g=0.2g,则所得溶液中溶质的质量为0.2g+16g=1.2g,
由于是三者混合物,则对应的溶液中的溶质的质量是大于16.2g小于18g,
故选C
点评 本题考查了根据化学方程式的计算,完成此题,可以依据反应的化学方程式结合题干提供的数据进行.

练习册系列答案
相关题目
7.钛(Ti)和钛合金被誉为“未来的金属材料”. 由+4价的钛元素和-2价的氧元素组成的氧化物的化学式书写正确的是( )
| A. | TiO2 | B. | Ti2O2 | C. | Ti2O | D. | Ti2O5 |
5.初中化学的很多反应可以表示为:甲+乙→丙+丁,下列说法中正确的是( )
| A. | 若甲是镁,丙是氢气,则乙一定是稀硫酸 | |
| B. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| C. | 若丙、丁分别是化合物和单质,则该反应一定是置换反应 | |
| D. | 若甲乙质量均为10g,则生成丙和丁的质量总和一定是20g |
11.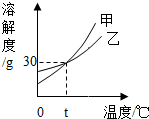 如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )
 如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )| A. | t℃时甲和乙的溶解度相等 | |
| B. | t℃时30g乙加到100g水中形成饱和溶液 | |
| C. | 从甲的饱和溶液中得到甲可用降温结晶的方法 | |
| D. | 甲的溶解度大于乙的溶解度 |
12.我们每天都和化学变化打交道,下列叙述是化学变化的是( )
| A. | 樟脑丸在衣橱中消失 | B. | 牛奶变酸 | ||
| C. | 木材做成课桌 | D. | 气候变暖,冰川消融 |
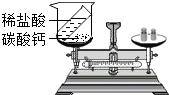 如图是探究质量守恒定律的实验装置图,回答下列问题:
如图是探究质量守恒定律的实验装置图,回答下列问题: