题目内容
12.下列图象分别与选项中的操作相对应,其中合理的是( )| A. | 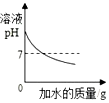 向一定量氢氧化钠溶液中滴入水 | |
| B. | 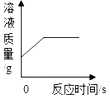 向一定量氯化铜溶液中加入一定量铝 | |
| C. | 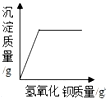 向一定量盐酸和硫酸钠混合溶液中滴入氢氧化钡溶液 | |
| D. | 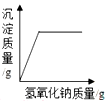 向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液 |
分析 A、根据氢氧化钠是碱性溶液,在稀释过程中不可能稀释成中性或酸性溶液进行分析;
B、根据氯化铜和铝反应生成氯化铝和铜进行分析;
C、根据硫酸根离子和钡离子一接触就会生成硫酸钡沉淀进行分析;
D、根据向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液,氢氧化钠会先与硫酸反应,再与硫酸铜反应进行分析.
解答 解:A、氢氧化钠是碱性溶液,在稀释过程中不可能稀释成中性或酸性溶液,故A错误;
B、每54份质量的铝和氯化铜反应生成氯化铝和192份质量的铜,所以反应后溶液质量先减小,然后不变,故B错误;
C、硫酸根离子和钡离子一接触就会生成硫酸钡沉淀,所以沉淀质量应该从零开始逐渐增大,然后不变,故C正确;
D、向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液,氢氧化钠会先与硫酸反应,再与硫酸铜反应,所以加入一定量的氢氧化钠后,才会出现沉淀,故D错误.
故选:C.
点评 本题是过程与图象结合题,是对学生识图能力的考查,解题的关键是能正确的分析各个反应的过程并能结合图象分析问题.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
3.下列物品所使用的材料中,属于有机合成材料的是( )
| A. | 钛合金表链 | B. | 纯棉手套 | C. | 手机塑料外壳 | D. | 真丝围巾 |
20.下列说法中,不正确的是( )
| A. | 用量筒量取一定量的水,读数时要平视液体凹形液面中央最低处 | |
| B. | 制作糖水时候,用玻璃棒搅拌可以加快糖的溶解 | |
| C. | 在用烧杯配制氢氧化钠溶液时,将氢氧化钠溶于水,会感觉烧杯壁比较热 | |
| D. | 因为氯化钠没有腐蚀性,所以可以直接在托盘天平上称量 |
17.一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究.
【实验一】取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验.
(1)通过上述实验可知,温度越高铁钉生锈速率越快(填“慢”或“快”);在酸性(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快.
【实验二】为探究铁锈的成分,用图1所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
【查阅资料】无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2.
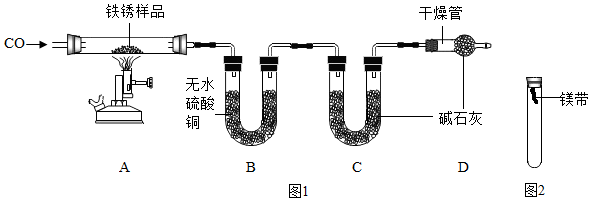
(2)请指出图1所示实验装置的一个明显缺陷:没有进行尾气处理.
(3)加热前,先通入CO一段时间,目的是排尽装置内的空气,防止发生爆炸.
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有氢元素,从而推断出空气中的水参加了铁生锈反应.
【实验记录】
(5)根据上表数据推算,可确定铁锈的成分,用FexOy•nH2O表示,则n=4;若缺少D装置,x:y的值偏小(填“偏大”、“偏小”或“无影响”).
(6)欲通过实验探究镁带在空气中锈蚀的条件,用图2所示装置,试管内可选用的物质如下:
①O2②水③CO2④O2和CO2⑤CO2和水⑥O2和水⑦O2、CO2和水
至少需要选用④⑤⑥⑦(填数字序号),才能达到探究镁带锈蚀的条件.
(7)请写出镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]的化学方程式6Mg+3O2+4CO2+2H2O=2Mg3(OH)2(CO3)2.
【实验一】取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验.
| 实验图示 | 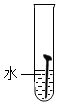 | 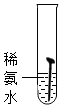 | 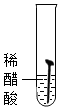 | 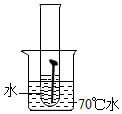 | 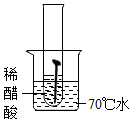 |
| 生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
【实验二】为探究铁锈的成分,用图1所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
【查阅资料】无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2.

(2)请指出图1所示实验装置的一个明显缺陷:没有进行尾气处理.
(3)加热前,先通入CO一段时间,目的是排尽装置内的空气,防止发生爆炸.
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有氢元素,从而推断出空气中的水参加了铁生锈反应.
【实验记录】
| 铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
| 反应前 | 23.2 | 232.4 | 198.2 |
| 反应后 | / | 239.6 | 211.4 |
(6)欲通过实验探究镁带在空气中锈蚀的条件,用图2所示装置,试管内可选用的物质如下:
①O2②水③CO2④O2和CO2⑤CO2和水⑥O2和水⑦O2、CO2和水
至少需要选用④⑤⑥⑦(填数字序号),才能达到探究镁带锈蚀的条件.
(7)请写出镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]的化学方程式6Mg+3O2+4CO2+2H2O=2Mg3(OH)2(CO3)2.
4.下列图象与变化关系正确的是( )
| A. |  向一片久置于空气中的铝片样品滴加过量盐酸 | |
| B. |  向一定质量的某碱溶液中逐渐滴加水 | |
| C. |  向硝酸钡溶液中滴加过量稀硫酸 | |
| D. |  充分加热氯酸钾与二氧化锰的混合物制取氧气 |
2.化学是一个五彩斑斓的世界,下列对物质的颜色或实验现象描述错误的是( )
| A. | 将活性炭放入红墨水中,红墨水褪色 | |
| B. | 硫在空气中燃烧产生蓝紫色火焰 | |
| C. | 用稀盐酸除铁锈后溶液变成黄色 | |
| D. | 铜绿加热后固体变成黑 |
