题目内容
3.某化学小组进行了氨气(NH3 )、氧气、二氧化碳的制取实验,根据有关信息回答下列问题:
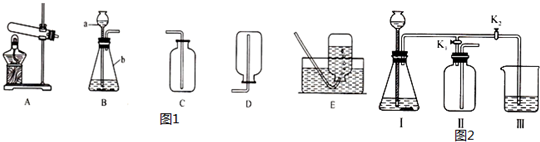
(1)写出标有序号的仪器名称:①试管,②分液漏斗.
(2)实验室制取氨气应选用的发生装置是A(填序号,下同),收集氨气应选择的装置是D,收集二氧化碳应该选择的装置是E.
(3)若用图2所示装置收集氨气,氨气应该从B端通入.(填“A”或“B”)
(4)实验室用F装置制取氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,相对于B装置而言,该装置的优点是随时控制反应的发生和停止.
(5)若实验室用A与C装置制取并收集氧气,下列实验操作正确的①.
①将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中;
②先将导管口移入集气瓶,再开始加热;
③收集O2后,将集气瓶移出水槽,然后盖上玻璃片;
④停止加热时,先熄灭酒精灯,再移出导气管;
⑤收集完氧气的集气瓶要盖上玻璃片,正放桌子上.
分析 (1)熟悉常见仪器,了解名称;
(2)根据实验室用加热氯化氨和消石灰的固体混合物制取氨气选择制取装置;根据氨气是一种密度比空气小,极易溶于水的气体,选择收集方法;根据二氧化碳密度大于空气的密度,并且易溶于水分析.
(3)根据氨气是一种密度比空气小的气体分析;
(4)根据F装置属于固-液不加热型写出反应的方程式;
(5)根据用加热装置制取氧气时的注意事项进行分析判断.
解答 解:(1)图中①是试管,②是分液漏斗.
故答案为:试管;分液漏斗.
(2)实验室制取氨气时需要加热,反应物都是固体,应该选择A装置制取氨气;氨气的密度比空气小,极易溶于水,只能用向下排气法收集;二氧化碳密度大于空气的密度,并且易溶于水,所以用向上排空气法收集.
(3)氨气是一种密度比空气小的气体,若用图2所示装置收集氨气,应该是“短进长出”.
(4)实验室制氧气的三种方法中只有分解过氧化氢溶液的方法选择固-液不加热型的发生装置,所以F装置适用于分解过氧化氢溶液制氧气;使用F装置比B装置的优点是随时控制反应的发生和停止.
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;随时控制反应的发生和停止.
(5)①用排水法收集氧气时,加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中,故正确;
②用排水法收集氧气时,当气泡均匀连续地放出时,才开始收集氧气,不能先将导管口移入集气瓶,再开始加热,故错误;
③用排水法收集氧气后,用玻璃片将瓶盖好后,移出水面正放在桌子上,故错误;
④氧气收集完毕,如果先将酒精灯熄灭,则试管内压强变小,水会沿导管倒流进试管,故错误.
⑤收集完氧气的集气瓶要盖上玻璃片,正放桌子上,故正确.
故选①⑤.
点评 本题难度不大,掌握实验室制取气体时的注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
| 充分反应后剩余固体质量/g | 7 | 4 | 2 | M |
(2)该石灰石样品中碳酸钙的质量分数.
(3)该稀盐酸的溶质质量分数.

(1)写出标有序号仪器的名称①酒精灯,②集气瓶.
(2)实验室可选用KMnO4制氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)实验室用大理石和稀盐酸反应制取二氧化碳,可选用的收集装置是D(填字母),检验二氧化碳是否收集满的方法是将燃着的木条放在集气瓶口,木条熄灭,证明集满.
(4)实验室用B装置制取O2时,反应很剧烈,请你提出一条与该实验有关的安全注意事项减慢过氧化氢溶液的滴加速度.
(5)某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为25.0g).
| 烧杯+盐酸 | 大理石 | 充分反应后烧杯+剩余物 | |
| 甲 | 75.0g | 13.2g | 83.8g |
| 乙 | 75.0g | 16.0g | 86.6g |
| 丙 | 95.0g | 13.2g | 103.8g |
【进行实验】
| 操作步骤 | 实验现象 | 实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 | A中无明显现象 B中有气体 C中有白色沉淀 | A中物质是食盐水 B中物质是稀盐酸 C中物质是澄清石灰水 |
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案.
【实验与探究】
(1)小林将所有废液倒入一洁净烧杯中,静置后得到上层清液.
(2)取少量清液加入适量的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现有白色沉淀且酚酞变红的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有Ca(OH)2、HCl.(填化学式)
【方法与应用】通过以上探究,处理上述废液的正确方法是:在废液中继续加入盐酸,调节溶液pH=7,蒸发获得氯化钠晶体.
 水是生命之源,我们应该了解水,爱护水资源.
水是生命之源,我们应该了解水,爱护水资源.