题目内容
19.NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO密度比空气略大,NO难溶于水,通常条件下易与氧气反应生成NO2.实验室收集NO的装置应选用( )| A. | 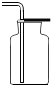 | B. | 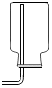 | C. |  | D. | 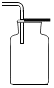 |
分析 气体的性质决定了应采取哪种收集方法,NO密度比空气略大可以用向上排空气法,但又因为通常条件下极易与氧气反应,所以不能用排空气法,NO难溶于水,可用排水法.
解答 解:
A、NO极易与氧气反应,所以不能用排空气法,所以A不正确;
B、NO密度比空气略大,通常条件下极易与氧气反应,不能用排空气法,所以B不正确;
C、NO极易与氧气反应,不能用排空气法,NO难溶于水,可用排水法,所以C正确;
D、NO极易与氧气反应,不能用排空气法,且导管位置也是错误的,所以D不正确.
故选C.
点评 气体的密度和溶水性决定了气体的收集方法,但还应考虑气体是不是和空气中的某种物质反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列反应中不属于复分解反应的是( )
| A. | H2SO4+Ca(OH)2═CaSO4+2H2O | B. | Na2SO4+BaCl2═BaSO4↓+2NaCl | ||
| C. | CO2+Ca(OH)2═CaCO3↓+H2O | D. | 2HCl+CaCO3═CaCl2+H2O+CO2↑ |
10.除去下列物质中的少量杂质,所选用的试剂和方法均正确的是( )
| 物质(括号内为杂质) | 所用试剂及方法 | |
| A | H2O(H2O2) | MnO2过滤 |
| B | 除去CO中的少量H2O和CO2 | 先通过浓H2SO4,再通过NaOH溶液 |
| C | CO2(CO) | 过量O2点燃 |
| D | Al(Al2O3) | 足量稀H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
7. 化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
 化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
化学变化多姿多彩,美丽如花.图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )| A. | C | B. | Fe2O3 | C. | CO | D. | 盐酸 |
14. 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
11.下列除杂试剂使用正确的是( )
| A. | 用NaOH溶液除去CO2中混有的HCl | |
| B. | 用水除去MnO2中混有的KCl | |
| C. | 用点燃的方法除去CO2中混有少量的CO | |
| D. | 用硝酸除去NaCl中混有的Na2CO3 |
9.下列物质中不是有机酸的是( )
| A. | 柑橘类水果中的柠檬酸 | B. | 食醋中的乙酸 | ||
| C. | 酸奶中的乳酸 | D. | 汽水中的碳酸 |
