题目内容
化工生产上通常将石膏(CaSO4)转化为硫酸钾肥料和氯化钙,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.如图是该转化的流程图.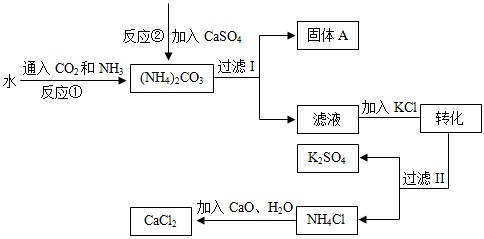
回答下列问题:
(1)写出反应①的化学方程式 .
(2)过滤I操作所得固体中,出CaSO4外还含有 (填化学式)等物质.
(3)过滤I操作所得滤液是溶液(NH4)2SO4.检验滤液中是否还含有CO32-的方法是 .
(4)已知不同温度下K2SO4的溶解度如下表:
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体 g.

回答下列问题:
(1)写出反应①的化学方程式
(2)过滤I操作所得固体中,出CaSO4外还含有
(3)过滤I操作所得滤液是溶液(NH4)2SO4.检验滤液中是否还含有CO32-的方法是
(4)已知不同温度下K2SO4的溶解度如下表:
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |
分析:(1)根据方程式的书写方法考虑;(2)根据碳酸铵与硫酸钙反应的生成物考虑(3)根据碳酸根离子与酸反应能生成二氧化碳考虑;(4)先算出60℃时K2SO4的饱和溶液591g中含溶质多少,含溶剂多少,这些溶剂质量在0℃溶解溶质质量,再用60℃溶质质量减去0℃溶质质量就是析出溶质质量.
解答:解:(1)反应物是氨气、水、二氧化碳,生成物是碳酸铵,用观察法配平,所以方程式是:2NH3+H2O+CO2═(NH4)2 CO3;
(2)碳酸铵与硫酸钙反应生成碳酸钙沉淀和硫酸铵,所以过滤I操作所得固体中,除CaSO4外还含有CaCO3;
(3)碳酸根离子与酸反应能生成二氧化碳,所以可以用稀盐酸来验证碳酸根离子即:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32;
(4)设60℃时K2SO4的饱和溶液591g中含溶质质量为X则:
=
解得X=91g,含有水:591g-91g=500g,设0℃500g水中最多溶解溶质质量为Y则:
=
解得Y=37g,所以60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体质量为:91g-37g=54g.
故答案为:(1)2NH3+H2O+CO2═(NH4)2 CO3;(2)CaCO3;(3)取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含;(4)54g.
(2)碳酸铵与硫酸钙反应生成碳酸钙沉淀和硫酸铵,所以过滤I操作所得固体中,除CaSO4外还含有CaCO3;
(3)碳酸根离子与酸反应能生成二氧化碳,所以可以用稀盐酸来验证碳酸根离子即:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32;
(4)设60℃时K2SO4的饱和溶液591g中含溶质质量为X则:
| X |
| 591g |
| 18.2g |
| 100g+18.2g |
| Y |
| 500g |
| 7.4g |
| 100g |
故答案为:(1)2NH3+H2O+CO2═(NH4)2 CO3;(2)CaCO3;(3)取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含;(4)54g.
点评:解答本题的难点是最后一个空,需要知道关于饱和溶液中计算的公式:
=
、
=
.
| 溶质 |
| 溶剂 |
| 溶解度 |
| 100g |
| 溶质 |
| 溶液 |
| 溶解度 |
| 100g+溶解度 |

练习册系列答案
相关题目
化工生产上通常将石膏(CaSO4)转化为硫酸钾肥料和氯化钙,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是该转化的流程图。

回答下列问题:
(1)写出反应①的化学方程式 。
(2)过滤I操作所得固体中,出CaSO4外还含有 (填化学式)等物质。
(3)过滤I操作所得滤液是溶液(NH4)2SO4。检验滤液中是否还含有CO32—的方法是 。
(4)已知不同温度下K2SO4的溶解度如下表:
|
温度(℃) |
0 |
20 |
60 |
|
溶解度(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体 g。
化工生产上通常将石膏(CaSO4)转化为硫酸钾肥料和氯化钙,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.如图是该转化的流程图.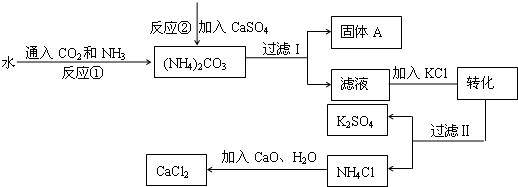
回答下列问题:
(1)写出反应①的化学方程式______.
(2)过滤I操作所得固体中,出CaSO4外还含有______(填化学式)等物质.
(3)过滤I操作所得滤液是溶液(NH4)2SO4.检验滤液中是否还含有CO32-的方法是______.
(4)已知不同温度下K2SO4的溶解度如下表:
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |