题目内容
纳米材料在绝大多数同学眼里都非常神秘.某化学学习小组决定通过查阅有关资料,自己动手实验,制备化学性质极为活泼的纳米铁粉.
【实验原理】
(1)用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)(溶解度较小).该反应的化学方程式是 .
(2)焙烧草酸亚铁:FeC2O4
Fe+2CO2↑
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、铁架台、硫酸亚铁、草酸等实验用品.为分离获得反应后的不溶物,缺少的玻璃仪器是 .
②若配制的硫酸亚铁溶液略呈黄色,可能原因是 .
(2)纳米铁粉的制备将一根玻璃管在酒精喷灯上烧制成如图2所示形状,向其中加入黄色草酸亚铁晶体.当草酸亚铁粉末受热完全变黑,立即将管口部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉.
①分解草酸亚铁的实验中所产生的CO2对于该实验步骤所起的作用是 .
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间.你认为烧熔过早、过晚的后果分别是 , .

【实验原理】
(1)用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)(溶解度较小).该反应的化学方程式是
(2)焙烧草酸亚铁:FeC2O4
| ||
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、铁架台、硫酸亚铁、草酸等实验用品.为分离获得反应后的不溶物,缺少的玻璃仪器是
②若配制的硫酸亚铁溶液略呈黄色,可能原因是
(2)纳米铁粉的制备将一根玻璃管在酒精喷灯上烧制成如图2所示形状,向其中加入黄色草酸亚铁晶体.当草酸亚铁粉末受热完全变黑,立即将管口部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉.
①分解草酸亚铁的实验中所产生的CO2对于该实验步骤所起的作用是
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间.你认为烧熔过早、过晚的后果分别是
考点:物质的相互转化和制备,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:【实验原理】
(1)根据复分解反应的特点“内项结合,外项结合”,进行书写“用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)”的化学方程式.
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①为分离获得反应后的不溶物为过滤操作,故可推测缺少的玻璃仪器.
②考虑黄色溶液可能是Fe3+的溶液.
(2)纳米铁粉的制备如图2
①考虑CO2的作用可能是隔绝氧气.
②准确把握玻璃管的烧熔封闭时间.考虑烧熔过早、过晚的可能后果:FeC2O4是否完全反应、铁是否与氧气反应.
(1)根据复分解反应的特点“内项结合,外项结合”,进行书写“用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)”的化学方程式.
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①为分离获得反应后的不溶物为过滤操作,故可推测缺少的玻璃仪器.
②考虑黄色溶液可能是Fe3+的溶液.
(2)纳米铁粉的制备如图2
①考虑CO2的作用可能是隔绝氧气.
②准确把握玻璃管的烧熔封闭时间.考虑烧熔过早、过晚的可能后果:FeC2O4是否完全反应、铁是否与氧气反应.
解答:解:
(1)根据复分解反应的特点“内项结合,外项结合”,进行书写“用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)”的化学方程式为FeSO4+H2C2O4═FeC2O4↓+H2SO4.
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①在该过程中的操作有过滤和蒸发,因此还需用到的玻璃仪器有漏斗,故答案为:漏斗
②若配制的硫酸亚铁溶液略呈黄色,可能原因是Fe2+被氧化成Fe3+;
(2)纳米铁粉的制备如图2
①分解草酸亚铁的实验中所产生的CO2,FeC2O4
Fe+2CO2↑,而CO2的作用可能是隔绝氧气,防止铁与氧气反应.
②准确把握玻璃管的烧熔封闭时间.过早:草酸亚铁固体没有完全分解;过晚:生成的铁粉被空气氧化.
故答案为:
(1)FeSO4+H2C2O4═FeC2O4↓+H2SO4
草酸亚铁的制备:①漏斗;②Fe2+被氧化成Fe3+
纳米铁粉的制备:①隔绝氧气;②过早:草酸亚铁固体没有完全分解;过晚:生成的铁粉被空气氧化
(1)根据复分解反应的特点“内项结合,外项结合”,进行书写“用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)”的化学方程式为FeSO4+H2C2O4═FeC2O4↓+H2SO4.
【操作步骤】
(1)草酸亚铁晶体的制备如图1
①在该过程中的操作有过滤和蒸发,因此还需用到的玻璃仪器有漏斗,故答案为:漏斗
②若配制的硫酸亚铁溶液略呈黄色,可能原因是Fe2+被氧化成Fe3+;
(2)纳米铁粉的制备如图2
①分解草酸亚铁的实验中所产生的CO2,FeC2O4
| ||
②准确把握玻璃管的烧熔封闭时间.过早:草酸亚铁固体没有完全分解;过晚:生成的铁粉被空气氧化.
故答案为:
(1)FeSO4+H2C2O4═FeC2O4↓+H2SO4
草酸亚铁的制备:①漏斗;②Fe2+被氧化成Fe3+
纳米铁粉的制备:①隔绝氧气;②过早:草酸亚铁固体没有完全分解;过晚:生成的铁粉被空气氧化
点评:主要考查了复分解反应的化学方程式的书写及在实验中应注意的一些实验操作,培养学生应用知识、解决问题的能力.

练习册系列答案
相关题目
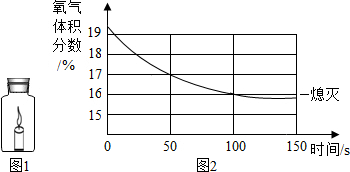 蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )
蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )| A、蜡烛燃烧前瓶内只有氧气 |
| B、蜡烛熄灭后瓶内只剩二氧化碳气体 |
| C、反应后有气体生成所以瓶内物质总质量减小 |
| D、氧气浓度小于一定值时,蜡烛无法燃烧 |


 用四个六边形表示A(碳酸钠溶液)、B(硝酸银溶液)、C(氯化钡溶液)、D(铁粉)四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:
用四个六边形表示A(碳酸钠溶液)、B(硝酸银溶液)、C(氯化钡溶液)、D(铁粉)四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题: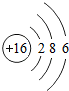 在宏观、微观和符号之间建立联系是化学学科的特点
在宏观、微观和符号之间建立联系是化学学科的特点 ”表示一个氯原子,则“
”表示一个氯原子,则“ ”表示
”表示