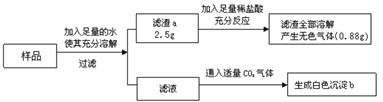
题目内容
【题目】资源与能源已成为人们日益关注的焦点。试回答:
(1)海水含量最多的盐类物质是________(填化学式)。
(2)在汽油中加入适量乙醇(C2H5OH)作为汽车燃料。写出乙醇充分燃烧的化学方程式_____。
(3)工业用焦炭、铁矿石、石灰石、空气为原料炼铁,炼铁的设备为_______,写出一氧化碳与赤铁矿反应的化学方程式___________,其中利用了一氧化碳的______(填“氧化性”或“还原性”)。
(4)每年因腐蚀而报废的金属数量惊人,写出生活中防止铁生锈的措施______(答一点即可)。
【答案】 NaCl C2H5OH+3O2点燃 2CO2+3H2O 高炉 3CO+Fe2O3 高温 2Fe+3CO2 还原性 在铁制品表面刷漆(保持表面干燥、表面涂油等合理答案)
【解析】(1)由金属离子(或铵根离子)和酸根离子构成的化合物叫盐,海水含量最多的盐类物质是氯化钠——NaCl;(2)乙醇充分燃烧生成二氧化碳和水,反应的化学方程式为C2H5OH+3O2点燃 2CO2+3H2O;(3)工业用焦炭、铁矿石、石灰石、空气为原料炼铁,炼铁的设备为高炉,一氧化碳与赤铁矿的主要成分氧化铁高温下反应生成二氧化碳和铁,化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2,其中利用了一氧化碳的还原性;(4) 铁生锈是铁与氧气、水共同作用的结果,所以防锈的方法有隔绝氧气、保持金属表面洁净干燥、改变金属的组成和结构;生活中防止铁生锈的措施:在铁制品表面刷漆(保持表面干燥、表面涂油等合理答案)。
2Fe+3CO2,其中利用了一氧化碳的还原性;(4) 铁生锈是铁与氧气、水共同作用的结果,所以防锈的方法有隔绝氧气、保持金属表面洁净干燥、改变金属的组成和结构;生活中防止铁生锈的措施:在铁制品表面刷漆(保持表面干燥、表面涂油等合理答案)。

 阅读快车系列答案
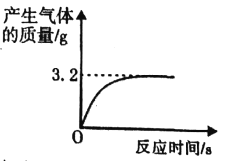
阅读快车系列答案【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
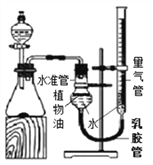
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
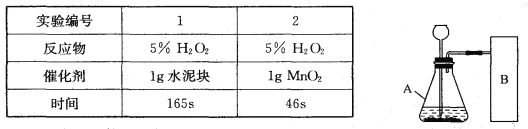
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
温度越高,过氧化氢分解的速率越大 |