题目内容
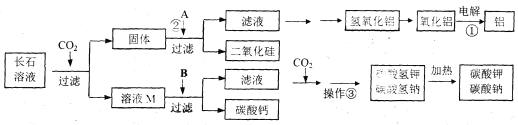
【题目】(7分)某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:

根据流程图回答:
(1)操作Ⅰ的名称是 ,加入的试剂A是 ,沉淀是 ;
(2)写出NaOH与杂质反应的化学方程式
(3)加入试剂B的目的是 ;
(4)蒸发结晶时用到玻璃棒的作用是
【答案】(1)过滤 , Na2CO3 , CaCO3;
(2)MgCl2 + 2NaOH === 2NaCl + Mg(OH)2↓
(3)除去滤液中多余NaOH和 Na2CO3 ;
(4)搅拌,使液体受热均匀,并加速蒸发
【解析】
试题分析:(1)食盐样品中含有少量沙土,通过操作Ⅰ将固体除去了,故该操作是过滤;滤液中加入氢氧化钠的目的是将氯化镁转化为氢氧化镁出来,要除去滤液中的氯化钙,那么要将钙离子转化为沉淀除去,故实际A是碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠;
(2)氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠:MgCl2 + 2NaOH === 2NaCl + Mg(OH)2↓;
(3)在除去氯化镁是加入的氢氧化钠和除氯化钙时加入的碳酸钠均是过量的,故要加入稀盐酸将它们转化为氯化钠;
(4)蒸发时要边加热边搅拌,目的是液体受热均匀,防止液体飞溅。

练习册系列答案
相关题目