题目内容
写出下列反应的符号表达式,并注明反应类型(填“化合反应”或“分解反应”)
(1)铁丝在氧气中燃烧: 反应类型 ;
(2)双氧水制氧气: 反应类型 ;
(3)电解水: 反应类型 ;
(4)实验室制二氧化碳 .
| 书写化学方程式、文字表达式、电离方程式;反应类型的判定.. | |
| 专题: | 化学用语和质量守恒定律. |
| 分析: | 铁在氧气中燃烧生成四氧化三铁; 过氧化氢在二氧化锰的催化作用下分解生成水和氧气; 电解水生成氢气和氧气; 实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳. |
| 解答: | 解:(1)铁丝在氧气中燃烧的化学方程式为:3Fe+2O2 (2)双氧水制氧气的化学方程式为:2H2O2 (3)电解水的化学方程式为:2H2O (4)实验室制二氧化碳的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑. 故填:3Fe+2O2 CaCO3+2HCl═CaCl2+H2O+CO2↑. |
| 点评: | 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”. |

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案水是生命之源,万物之基,是人类最宝贵的自然资源。
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面。达标后方可以成为生活饮用水。各种指标的主要要求为:
a.不得呈现异色 b.不得有异嗅异味 c. 水应澄清透明 d.不得含有细菌和病毒
①前两个指标可以利用活性炭的 作用而达到;
②自来水厂生产自来水的过程如下图所示:
 由上图可知净化水时,c、d两个指标可通过上图中的B、C、 过程而达到。
由上图可知净化水时,c、d两个指标可通过上图中的B、C、 过程而达到。
③水的硬度是一项重要的化学指标。日常生活中经常使用 来区分硬水与软水。常用 的方法来降低水的硬度。
(2)下列各种水中属于纯净物的是 ;
A.矿泉水 B.自来水 C.蒸馏水 D.汽水
(3)做好生活饮用水消毒工作,是预防肠道传染病的关键。适用于饮用水消毒的常用消毒剂有:漂白粉。漂白粉的主要成分是氯化钙【CaCl2】和次氯酸钙【Ca(ClO)2】。根据漂白粉的信息,请你判断漂白粉属于 (纯净物、混合物),关于漂白粉的说法中,不合理的是:
A.氯化钙【CaCl2】和次氯酸钙【Ca(ClO)2】中氯元素的化合价相同
B.氯化钙【CaCl2】和次氯酸钙【Ca(ClO)2】都是含氧化合物
C.氯化钙【CaCl2】和次氯酸钙【Ca(ClO)2】均属于化合物
(4)水的用途广泛,许多化学实验中用到水,请你列举一例有水参加的分解反应,写出相应的化学方程式: 。
| 河段编号 | 水质类别 | 主要污染指标 | 质量状况 |
| 甲 | II | / | 良好 |
| 乙 | IV | 汞 | 一般 |
| 丙 | 劣V | 总磷、氨(NH3)氮等 | 较差 |
(5)右表是某市水环境监测中心发布的该市境内团结河三个不同河段水资源质量状况中的部分内容:
①主要污染指标表述的文字中,涉及到的元素有N、_ _、___ 等 (写出两种元素符号) 。
②为保护水源,下列做法中,正确的是 ;
A.在河流的岸边堆放垃圾 B.向河流中排放非经处理的工业废水
C.在河流两岸植树造林 D.向湖泊中中直接倾倒生活污水
③高铁酸钠(Na2FeO4)是被科学家们公认为绿色消毒剂。它的消毒和除污效果全面优于含氯消毒剂。根据获得的信息计算:a.高铁酸钠中各元素的质量比为 。b.高铁酸钠中铁元素的质量分数为 。c.与232g四氧化三铁含氧量相等的高铁酸钠的质量为 。
下列实验中,能达到实验目的是( )
|
| A. | 比较MnO2和Fe2O3的催化效果 | B. | 制取并收集CO2气体 |
|
| C. |
测定空气中氧气的含量 | D. |
证明CO2的密度比空气大 |
小丽同学在一次课外实验探究酸的化学性质时误将过氧化氢(H2O2)溶液当作酸与氧化铁(Fe2O3)粉末混合,发现有大量气泡产生.她联想到二氧化锰(MnO2)可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白.
【猜想】Fe2O3能否作为H2O2分解的催化剂.
【实验验证】小丽同学一次设计了三个实验
实验一取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,观察到木条没有复燃,说明H2O2溶液常温下分解缓慢.
实验二在实验一的试管中加入wg Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,观察到木条复燃,说明 .
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为wg,说明 .
【实验结论】小丽同学认为,Fe2O3粉末可以作为H2O2分解的催化剂.
【反思评价】小江同学认为要证明小丽同学的结论正确,仅做这三个实验还不充分,需要补充一个探究实验,探究 .
【拓展】下表是同学们探究影响H2O2分解因素时所记录的部分数据:
用足量等体积H2O2溶液制取相同体积O2所需时间
|
| 30% H2O2 溶液 | 15% H2O2 溶液 | 5% H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
通过对表格中的数据进行分析,你能得出的结论是 .
【延伸】小明同学看到Fe2O3也能做H2O2分解的催化剂,还联想到一种蓝色的CuSO4溶液也能做H2O2分解的催化剂,请你一起参与计算:
(1)CuSO4的相对分子质量 ;
(2)80g CuSO4中铜氧元素的质量?(写出计算过程)
某同学用量筒取液体,量筒平稳且面向刻度线,初次平视液面,读数为19mL,倾倒出部分液体后,俯视液面,读数是11mL,则实际倾倒出液体的体积是( )
|
| A. | 8mL | B. | 大于8mL | C. | 小于8mL | D. | 无法判断 |
 Fe3O4,反应物是两种,生成物是一种,属于化合反应;
Fe3O4,反应物是两种,生成物是一种,属于化合反应;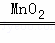 2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应;
2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应; 2H2↑+O2↑,反应物是一种,生成物是两种,属于分解反应;
2H2↑+O2↑,反应物是一种,生成物是两种,属于分解反应;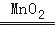 2H2O+O2↑,分解反应;2H2O
2H2O+O2↑,分解反应;2H2O 2H2↑+O2↑,分解反应;
2H2↑+O2↑,分解反应;








