题目内容
12.有A、B、C、D四种元素,已知A元素的原子是自然界中质量最小的原子;B元素的常见单质占空气体积的21%;C元素的一种单质是天然物质里硬度最大的晶体;D元素以化合态广泛存在于石灰石等矿物中,它的阳离子带有两个单位的正电荷.请回答:(1)A元素的单质的化学式是H2;D元素的阳离子的符号是Ca2+;B元素所形成的常见单质的一种用途是供给呼吸等.
(2)由CB2转化为DCB3的化学方程式是CO2+Ca(OH)2═CaCO3↓+H2O.
分析 有A、B、C、D四种元素,已知A元素的原子是自然界中质量最小的原子,则A为氢元素;B元素的常见单质占空气体积的21%,氧气约占空气体积的21%,则B为氧元素;C元素的一种单质是天然物质里硬度最大的晶体(金刚石),则C为碳元素;D元素以化合态广泛存在于石灰石等矿物中,它的阳离子带有两个单位的正电荷,石灰石的主要成分是碳酸钙,钙离子带有两个单位的正电荷,则D为钙元素;据此进行分析解答.
解答 解:有A、B、C、D四种元素,已知A元素的原子是自然界中质量最小的原子,则A为氢元素;B元素的常见单质占空气体积的21%,氧气约占空气体积的21%,则B为氧元素;C元素的一种单质是天然物质里硬度最大的晶体(金刚石),则C为碳元素;D元素以化合态广泛存在于石灰石等矿物中,它的阳离子带有两个单位的正电荷,石灰石的主要成分是碳酸钙,钙离子带有两个单位的正电荷,则D为钙元素.
(1)A元素的单质为氢气,其化学式为:H2;D元素的阳离子为钙离子,其离子符号为Ca2+;B元素所形成的常见单质为氧气,可用于供给呼吸和支持燃烧.
(2)由CB2转化为DCB3,即由二氧化碳转化为碳酸钙,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
故答案为:(1)H2;Ca2+;供给呼吸等;(2)CO2+Ca(OH)2═CaCO3↓+H2O.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列实验数据,记录合理的是( )
| A. | 用生活中常用的温度计测得某溶液温度为25.68℃ | |
| B. | 用10mL量筒量取98%的H2SO4溶液3.68mL | |
| C. | 用“pH试纸”测得某血浆的pH=7 | |
| D. | 用托盘天平称取5.85g粗盐 |
1.《环境空气质量标准》中的PM2.5指标,是指大气中直径小于或等于2.5微米的颗粒物,下列措施,能减少PM2.5污染的是( )
| A. | 用清洁能源代替化石燃料 | B. | 将生活垃圾焚烧处理 | ||
| C. | 大力发展煤炭火力发电 | D. | 多开私家车出行 |
7.某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计,实施和评价,并得出有关结论.
(1)探究稀硫酸与氢氧化钠溶液的反应:
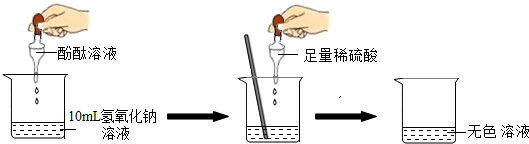
当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是方案二(填“方案一”或“方案二”)
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
小明认为NaOH溶液和H2SO4溶液混合时没有明显的现象,无法说明两者是否发生了反应.
①她设计如图实验证明二者之间确实发生了反应,所用的试剂有NaOH溶液、H2SO4溶液、CuSO4溶液.请在箭头上方的括号中填入试剂名称,并用“少量”、“足量”等指明试剂的用量.
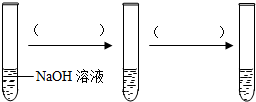
(2)如果把CuSO4溶液换成另一种试剂,只要各试剂的用量适当,则不管加入试剂的顺序如何,都能证明两者发生了反应,这种试剂是酚酞试液(或石蕊试液).
(1)探究稀硫酸与氢氧化钠溶液的反应:

当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
小明认为NaOH溶液和H2SO4溶液混合时没有明显的现象,无法说明两者是否发生了反应.
①她设计如图实验证明二者之间确实发生了反应,所用的试剂有NaOH溶液、H2SO4溶液、CuSO4溶液.请在箭头上方的括号中填入试剂名称,并用“少量”、“足量”等指明试剂的用量.

(2)如果把CuSO4溶液换成另一种试剂,只要各试剂的用量适当,则不管加入试剂的顺序如何,都能证明两者发生了反应,这种试剂是酚酞试液(或石蕊试液).

 初中化学中几种常见物质之间的相互转化关系如图所示.已知常温下B、C为气体,且B是植物进行光合作用的一种重要原料;D、F均为无色液体,都由两种相同的元素组成,E是黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).
初中化学中几种常见物质之间的相互转化关系如图所示.已知常温下B、C为气体,且B是植物进行光合作用的一种重要原料;D、F均为无色液体,都由两种相同的元素组成,E是黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).
 用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是:
用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.实验过程是: