题目内容
(2009?常州二模)取12g石灰石样品放入盛有105.4g稀盐酸溶液的烧杯中,恰好完全反应.有关实验数据如下表:(假设石灰石样品中杂质不与稀盐酸反应也不溶于水,且不考虑反应过程中水分和HCl气体的挥发)| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150g | 12g | 157.6g | |
(2)该石灰石样品中碳酸钙的质量分数为______(结果精确到0.1%).
(3)计算反应后所得溶液的溶质质量分数.
【答案】分析:石灰石中的主要成分碳酸钙与盐酸反应放出气体二氧化碳,恰好完全反应后所剩余物质的质量小于反应前各物质的质量和,根据质量守恒定律,质量的差即为反应所放出二氧化碳的质量;
根据反应的化学方程式,利用生成二氧化碳的质量,计算样品中碳酸钙的质量;碳酸钙的质量与样品质量比即样品中碳酸钙的质量分数;
恰好完全反应后所得溶液为氯化钙溶液,其溶液的质量分数= ;氯化钙的质量可由恰好完全反应时生成二氧化碳的质量求得,反应后溶液的质量可利用质量守恒而求得.
;氯化钙的质量可由恰好完全反应时生成二氧化碳的质量求得,反应后溶液的质量可利用质量守恒而求得.
解答:解:(1)根据质量守恒定律,反应中生成二氧化碳的质量=150g+12g-157.6g=4.4g
故答案为:4.4;
(2)设恰好完全反应时参加反应碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
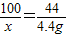
x=10g
该石灰石样品中碳酸钙的质量分数=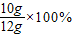 ≈83.3%
≈83.3%
故答案为:83.3%;
(3)设恰好完全反应时生成氯化钙的质量为y
CaCl2~CO2
111 44
y 4.4g
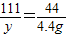 y=11.1g
y=11.1g
反应后所得溶液的溶质质量分数=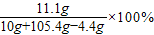 =10%
=10%
答:反应后所得溶液的溶质质量分数为10%.
点评:利用质量守恒定律,恰好完全反应后溶液的质量=参加反应的碳酸钙的质量+所加稀盐酸的质量-生成气体二氧化碳的质量.
根据反应的化学方程式,利用生成二氧化碳的质量,计算样品中碳酸钙的质量;碳酸钙的质量与样品质量比即样品中碳酸钙的质量分数;
恰好完全反应后所得溶液为氯化钙溶液,其溶液的质量分数=
 ;氯化钙的质量可由恰好完全反应时生成二氧化碳的质量求得,反应后溶液的质量可利用质量守恒而求得.
;氯化钙的质量可由恰好完全反应时生成二氧化碳的质量求得,反应后溶液的质量可利用质量守恒而求得.解答:解:(1)根据质量守恒定律,反应中生成二氧化碳的质量=150g+12g-157.6g=4.4g
故答案为:4.4;
(2)设恰好完全反应时参加反应碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
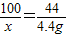
x=10g
该石灰石样品中碳酸钙的质量分数=
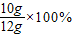 ≈83.3%
≈83.3%故答案为:83.3%;
(3)设恰好完全反应时生成氯化钙的质量为y
CaCl2~CO2
111 44
y 4.4g
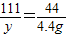 y=11.1g
y=11.1g反应后所得溶液的溶质质量分数=
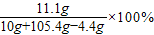 =10%
=10%答:反应后所得溶液的溶质质量分数为10%.
点评:利用质量守恒定律,恰好完全反应后溶液的质量=参加反应的碳酸钙的质量+所加稀盐酸的质量-生成气体二氧化碳的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2009?常州二模)阿司匹林泡腾片是一种白色片状固体,含有可溶于水、具有酸的通性的固体酸,属于内服的非处方药,具有解热镇痛作用,常用于治疗感冒发烧等疾病.将阿司匹林泡腾片放入足量的水中,会产生大量气泡.充分反应后过滤,能得到白色固体甲和无色澄清滤液乙.如下是某化学兴趣小组的探究过程:
[提出问题]白色固体甲中含有什么物质?
[实验探究]请你完成如下实验报告.
[提出新问题]固体甲中的碳酸盐是什么?
[猜想假设]猜想一:含有碳酸钠;猜想二:含有碳酸钙;猜想三:含有碳酸钡;
[收集证据](1)小飞同学认为猜想一错误的原因是______;
(2)小琴同学认为猜想三不合理的原因是______;
[得出结论]小王同学查阅资料发现“含Ca元素的物质在酒精灯上灼烧会产生砖红色火焰”,利用这一性质,小王经过一系列实验后确定固体甲中的碳酸盐是碳酸钙.
[反思交流]回忆起“将阿司匹林泡腾片放入足量的水中,会产生大量气泡”这一现象,小组同学认为产生实验现象的主要原因是______.若向无色澄清滤液乙中滴加碳酸钠溶液,产生白色沉淀,说明滤液乙中一定含有的金属阳离子是______.
[提出问题]白色固体甲中含有什么物质?
[实验探究]请你完成如下实验报告.
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 取少量固体甲样品与试管内,向试管内滴加碘酒溶液 | 样品呈蓝色 | 固体甲中含有______ |
| ② | ______ | ______ | 固体甲中含有碳酸盐. |
[猜想假设]猜想一:含有碳酸钠;猜想二:含有碳酸钙;猜想三:含有碳酸钡;
[收集证据](1)小飞同学认为猜想一错误的原因是______;
(2)小琴同学认为猜想三不合理的原因是______;
[得出结论]小王同学查阅资料发现“含Ca元素的物质在酒精灯上灼烧会产生砖红色火焰”,利用这一性质,小王经过一系列实验后确定固体甲中的碳酸盐是碳酸钙.
[反思交流]回忆起“将阿司匹林泡腾片放入足量的水中,会产生大量气泡”这一现象,小组同学认为产生实验现象的主要原因是______.若向无色澄清滤液乙中滴加碳酸钠溶液,产生白色沉淀,说明滤液乙中一定含有的金属阳离子是______.


