题目内容
根据信息写出化学方程式:
(1)打火机中的燃料C4H10完全燃烧:_________________。
(2)手机. 笔记本电脑等电子产品中使用的锂电池具有体积小. 放电时间长等优点,其放电时的工作原理是锂(Li)与二氧化锰作用生成LiMnO2:___________________ 。
(3)海洋中资源丰富,如碘(I2)的获得可将海藻. 海带经处理后所得的NaI溶液与Cl2发生置换反应而得到。该反应的化学方程式为:_____________________ 。
(4)一些豆科植物能将空气中的氮气转化为能被作物吸收的氮的化合物,其反应可看作是氮气. 碳. 水在根瘤菌的催化作用下生成了氨(NH3)和二氧化碳: __________________。
(5)在400℃左右,有催化剂的条件下,用氨气可将有毒气体NO还原为水和氮气。该反应的化学方程式为: ___________________。
(1)打火机中的燃料C4H10完全燃烧:_________________。
(2)手机. 笔记本电脑等电子产品中使用的锂电池具有体积小. 放电时间长等优点,其放电时的工作原理是锂(Li)与二氧化锰作用生成LiMnO2:___________________ 。
(3)海洋中资源丰富,如碘(I2)的获得可将海藻. 海带经处理后所得的NaI溶液与Cl2发生置换反应而得到。该反应的化学方程式为:_____________________ 。
(4)一些豆科植物能将空气中的氮气转化为能被作物吸收的氮的化合物,其反应可看作是氮气. 碳. 水在根瘤菌的催化作用下生成了氨(NH3)和二氧化碳: __________________。
(5)在400℃左右,有催化剂的条件下,用氨气可将有毒气体NO还原为水和氮气。该反应的化学方程式为: ___________________。
(1) 2C4H10 +13O2  8CO2+10H2O
8CO2+10H2O
(2)Li +MnO2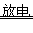 LiMnO2
LiMnO2
(3)Cl2 + 2NaI =I2+2NaCl
(4) N2+3C+3H2O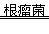 2NH3 + 3CO2
2NH3 + 3CO2
(5) 4NH3+6NO 6H2O+5N2
6H2O+5N2
 8CO2+10H2O
8CO2+10H2O(2)Li +MnO2
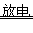 LiMnO2
LiMnO2(3)Cl2 + 2NaI =I2+2NaCl
(4) N2+3C+3H2O
 2NH3 + 3CO2
2NH3 + 3CO2 (5) 4NH3+6NO
 6H2O+5N2
6H2O+5N2 
练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下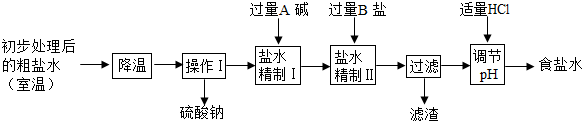
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
Na2CO3+H2O+CO2↑
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下

①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.

②“精制I”操作中,加入过量含钙元素的碱的化学式是
③“精制II”操作中,加入B盐的有关反应方程式为
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
| ||
 CO2+2H2O
CO2+2H2O