题目内容
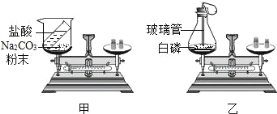
【题目】某同学用如图所示的装置探究质量守恒定律,锥形瓶内是红磷。

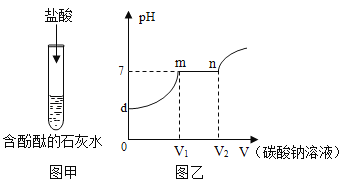
(1)反应前锥形瓶内红磷和氧气的质量总和不一定等于反应后生成五氧化二磷的质量,为什么______________?
(2)实验过程中气球鼓起,实验后比实验前还瘪。请解释气球发生上述变化的原因______________。
【答案】如果红磷和氧气恰好完全反应,生成的五氧化二磷的质量等于红磷和氧气的质量总和。如果红磷剩余或氧气剩余,生成的五氧化二磷的质量小于红磷和氧气的质量总和 红磷燃烧放出热量,导致锥形瓶中压强增大,气球膨胀。反应后冷却至室温时,由于氧气被消耗,锥形瓶中压强减小,小于外界压强,气球缩小,并且实验后比实验前还瘪
【解析】
(1)反应前锥形瓶内红磷和氧气的质量总和不一定等于反应后生成五氧化二磷的质量,是因为红磷和氧气不恰好完全反应时红磷和氧气的质量总和大于反应后生成五氧化二磷的质量;
(2)实验过程中气球鼓起,实验后比实验前还瘪,原因:红磷燃烧放热,气压增大,导致气球膨胀;完全反应后氧气消耗,温度降低,锥形瓶中压强减小,小于外界压强,气球缩小,并且实验后比实验前还瘪。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】小宇查阅资料得知:氯酸钾在二氧化锰、氧化铁等物质作催化剂条件下可生成氯化钾和氧气。于是,他对影响氯酸钾分解的因素及催化剂的效果产生了探究兴趣。
(提出问题)氧化铁是否比二氧化锰催化效果更好?
(设计实验)小宇以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3 | 其它物质的质量 | 温度 | 收集氧气的体积 | 反应时间 |
① | 10.0g | 无 | 330℃ | 100mL | t1 |
② | 10.0g | 氧化铁1.5g | 330℃ | 100mL | t2 |
③ | 10.0g | 二氧化锰1.5g | 330℃ | 100mL | t3 |
④ | 10.0g | 二氧化锰xg | 380℃ | 100mL | t4 |
(结论与反思)
(1)若t1________t2(选填“>”、“=”或“<”),说明氧化铁能加快氯酸钾的分解速率。若要确定氧化铁是氯酸钾分解反应的催化剂,还需探究反应前后氧化铁的________和________不变。
(2)若t2>t3,说明氧化铁对氯酸钾分解的催化效果比二氧化锰________(填“强”或“弱”)。
(3)写出实验④所涉及反应的化学方程式__________________。
(4)实验④中MnO2的质量x为________g,若t3 > t4,则化学反应速率与温度的关系是______________。
(5)氯酸钾的分解速率可能还与_____________________因素有关,需设计实验进一步证明。