题目内容
分析:首先搞清:①石灰石的主要成分是CaCO3;②混合物减少的质量即CaCO3跟盐酸反应,生成CO2的质量;③根据化学方程式中CaCO3与盐酸、CO2的质量关系可计算出CaCO3的质量和用去盐酸的质量,再根据密度即可求出盐酸的体积。
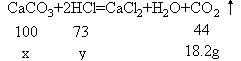 解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
解:设参加反应的CaCO3的质量为xg,盐酸溶液中的溶质质量为y。
100∶44=x∶18.2g x=41.4g
 73∶44 = y∶18.2g y=30.2g
73∶44 = y∶18.2g y=30.2g
消耗盐酸=30.2g÷20%=151g
20%盐酸的体积=151/1.10=137.3(mL)答:略。
在已平衡的托盘天平的甲、乙两烧杯中分别加入等质量等质量分数的稀硫酸,并在甲烧杯中加入m1铝片,在乙烧杯中加入m2铁片。
(1)若m1=m2,且两烧杯中金属完全溶解,则天平指针______(填“不偏转”或“偏甲”、“偏乙”),其理由是______。
(2)若两烧杯中金属完全溶解,天平指针不偏转,则m1:m2=______:______。

练习册系列答案
相关题目
石灰石是我市的一种重要矿产资源,为了测定某石灰石样品中碳酸钙的含量,某同学用该石灰石样品与稀盐酸反应(杂质既不溶于水也不与盐酸反应),进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
(1)请计算该石灰石样品中碳酸钙的质量分数.
(2)从上表数据中分析,当所取石灰石与所用稀盐酸的质量比为 时,表明石灰石中的碳酸钙与稀盐酸中的氯化氢恰好完全反应.
| 第一次 | 第二次 | 第三次 | |
| 所取石灰石合金的质量/g | 25 | 25 | 50 |
| 所用稀盐酸的质量/g | 120 | 160 | 100 |
| 二氧化碳的质量/g | 9.9 | 9.9 | 9.9 |
(2)从上表数据中分析,当所取石灰石与所用稀盐酸的质量比为
实验探究是化学的灵魂,请你参与实验室制取氧气和二氧化碳的探究活动.
Ⅰ.制取氧气方法的分析

(1)写出A、B装置中标号仪器名称:① ;② .
(2)写出一个用A或B装置制取氧气的化学方程式 .
(3)若用B装置制取一瓶氧气,验满的方法是 .
(4)上述两种方法中,更符合“低碳”理念的是 (填“A”或“B”).
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为 .
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
[分析一]实验室 (填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳.
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是 .
[结 论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
[问题三]要得出该结论,上述两组对比实验中,[实验二]所取稀盐酸的体积是 mL、
溶质质量分数是 .
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有 (写一种即可).
Ⅰ.制取氧气方法的分析

(1)写出A、B装置中标号仪器名称:①
(2)写出一个用A或B装置制取氧气的化学方程式
(3)若用B装置制取一瓶氧气,验满的方法是
(4)上述两种方法中,更符合“低碳”理念的是
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
| 实验步骤 | 实验现象 |
 |
A中不断产生气泡,固体逐渐减少,有少量固体剩余. B中开始有少量气泡产生,反应很快停止. |
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
| 实验步骤 | 实验现象 |
 |
A中迅速产生大量气泡,固体很快减少,有少量固体剩余. B、C中都迅速产生大量气泡,固体很快消失. |
[结 论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
[问题三]要得出该结论,上述两组对比实验中,[实验二]所取稀盐酸的体积是
溶质质量分数是
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有