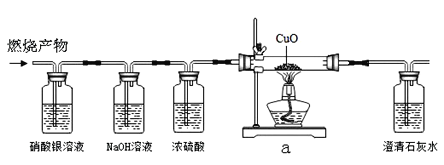
题目内容
【题目】硫铁矿[主要成分是二硫化亚铁(FeS2)]是一种重要的化工原料,常用来制备硫酸和氯化铁,工业生产流程如图所示。

(1)步骤Ⅱ中主要反应的化学方程式为________________________,过滤和蒸发结晶中都需要的仪器包括:铁架台、________。
(2)上述流程中所涉及的含硫的物质中,硫元素的化合价共有________种。
(3)若硫铁矿中的硫元素可完全转化为硫酸,则150 t含80%的硫铁矿可制得硫酸的质量为________吨。
【答案】Fe2O3+6HCl=2FeCl3+3H2O 玻璃棒 3 196
【解析】
(1)步骤Ⅱ中氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;过滤和蒸发结晶中都需要的仪器包括:铁架台、玻璃棒;
(2)上述流程所涉及的物质中含硫的物质分别是FeS2、SO3、SO2,在二硫化亚铁中铁元素是+2价,根据在化合物中正负化合价代数和为零,求得硫元素化合价是-1价;在SO3中氧元素是-2价,所以硫元素是+6价,在SO2中氧元素显-2价,所以硫元素显+4价,H2SO4中氢元素显+1价,氧元素显-2价,其中的硫元素显+6价。二氧化硫、三氧化硫、硫酸中硫元素的化合价分别是-1价、+4价、+6价、+6价,硫元素的化合价共有三种;
(3)若硫铁矿中的硫元素可完全转化为硫酸,则150t含80%的硫铁矿可制得硫酸的质量为150t×80%×(![]() ×100%)÷(
×100%)÷(![]() ×100%)=196t。
×100%)=196t。

练习册系列答案
相关题目