题目内容
14.根据下列材料作答:材料一:反应前后,有元素化合价变化的化学反应是氧化还原反应.其中,有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂.
粉尘
材料二:酸雨形成的原因主要有两种:
①3NO2+H2O═2HNO3+X
②2SO2+O2+2H2O═2H2SO4
(1)材料二中反应①的X为NO(填化学式).
(2)材料二中反应②的基本反应类型为化合反应.
(3)结合材料一、二,下列说法正确的是AC(填序号).
A.反应①②都属于氧化还原反应B.反应①中H2O作还原剂
C.反应②中SO2作还原剂 D.反应②中O2发生氧化反应
(4)为了减少城市酸雨的产生,下列措施正确的是ABCD(填序号).
A.使用低硫煤、节约用煤B.大力发展公共交通
C.安装尾气净化器及节能装置 D.努力开发新能源.
分析 (1)根据质量守恒定律,化学反应前后原子的种类和数目不变解答;
(2)根据反应类型分析判断;
(3)根据氧化还原反应的定义解答;
(4)根据二氧化硫和氮氧化物,这些物质和水反应能生成显酸性的物质,达到一定程度时会形成酸雨解答.
解答 解:
(1)根据质量守恒定律,化学反应前后原子的种类和数目不变,3NO2+H2O═2HNO3+X 中,反应前:N、O、H的原子个数分别是:3、7、2;反应后:N、O、H的原子个数分别是:2、6、2;则X中有一个氮原子和一个氧原子,材料二中反应①的X为NO;
(2)材料二中反应②2SO2+O2+2H2O═2H2SO4符合多变一,基本反应类型为化合反应;
(3)
A、反应①②中元素的化合价都有变化,都属于氧化还原反应故正确;
B、反应①中H2O中的氢元素和氧元素的化合价没有发生改变,H2O不作还原剂,故错误;
C、反应②中SO2中硫元素的化合价升高,作还原剂,故正确;
D、反应②中O2发生还原反应,故错误.
(4)A.使用低硫煤、节约用煤,可以减少二氧化硫、氮氧化物的产生,有利于防止酸雨的产生;
B、大力发展公共交通,节约用煤,可以减少二氧化硫、氮氧化物的产生,有利于防止酸雨的产生;
C、安装尾气净化器及节能装置,可以减少尾气的排放,有利于防止酸雨的产生;
D、努力开发新能源,以减少二氧化硫、氮氧化物的产生,有利于防止酸雨的产生.
答案:
(1)NO;
(2)化合反应;
(3)AC
(4)ABCD.
点评 解答本题要理解只有减少或杜绝二氧化硫、氮氧化物的排放才能有效地防止酸雨.

练习册系列答案
相关题目
4.下列变化属于化学变化的是( )
| A. | 汽油挥发 | B. | 水电解 | C. | 工业制氧 | D. | 蜡烛熔化 |
5.某学生用量筒取液体时,量筒平稳地放置在实验台上,使视线与凹液面的最低点保持水平,读数为18mL;倒出部分液体后,俯视凹液面的最低处,读数为12mL,则该学生实际倒出的液体体积为( )
| A. | 肯定大于6 mL | B. | 肯定小于6 mL | ||
| C. | 肯定等于6 mL | D. | 可能大于也可能小于6 mL |
2.下列各组物质加水充分搅拌,只得到无色溶液的是( )
| A. | Fe(OH)3 H2SO4 | B. | CuSO4 NaOH | C. | Na2CO3 KOH | D. | CaCl2 K2CO3 |
9.料酒中的乙醇和食醋中的醋酸能发生反应,生成具有芳香气味的乙酸乙酯(C4H8O2),因此炒菜时加料酒和食醋可以调香.下列关于乙酸乙酯说法正确的是( )
| A. | 乙酸乙酯由4个碳原子、8个氢原子和2个氧原子构成 | |
| B. | 乙酸乙酯中C、H、O三种元素的质量比为4:8:2 | |
| C. | 乙酸乙酯的相对分子质量为88g | |
| D. | 乙酸乙酯是有机物 |
6.下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化碳:CO2+2NaOH═Na2CO3+H2O 复分解反应 | |
| B. | 溶洞的形成:CaCO3+H2O+CO2═Ca(HCO2)2 化合反应 | |
| C. | 实验室制取氢气:Fe+2HCl═FeCl2+H2 置换反应 | |
| D. | 用氢氧化镁治疗胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O 中和反应 |
4.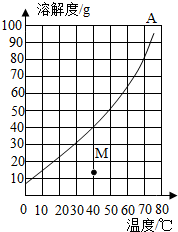 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
(1)请根据如表数据在图上绘制出B物质的溶解度曲线.
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.
 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度. | 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| B物质溶解度/g | 32 | 35 | 40 | 45 | 55 |
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.
