题目内容
19.厨房中蕴含许多化学知识,请根据下列要求回答问题.(1)鱼虾腐烂会产生H2S,这与鱼虾中含有的C有关.
A.淀粉 B.维生素 C.蛋白质 D.油脂
(2)实验室常用湿润的硝酸铅试纸检验H2S,已知硝酸铅[Pb(NO3)2]与H2S发生复分解反应生成灰黑色沉淀,写出该反应的方程式Pb(NO3)2+H2S═PbS↓+2HNO3.
(3)判断煮饭用水是硬水还是软水,方法是:取样,加肥皂水,产生泡沫较少且有白色垢状物为硬水,反之为软水.家用净水器中含有大量的活性炭,其起到的是吸附作用.
(4)餐具上的油污可用洗洁精来清洗,这是利用洗洁精的乳化作用.
分析 (1)从硫化氢(H2S)是由氢元素和硫元素组成的,根据质量守恒定律,生成硫化氢的物质中要有氢元素和硫元素去分析解答;
(2)从硝酸铅[Pb(NO3)2]与H2S发生复分解反应,相互交换成分生成硫化铅和硝酸去分析解答;
(3)我们通常把含有较多可溶性钙、镁化合物的水叫硬水以及硬水的鉴别和软化方法以及活性炭具有吸附性,能吸附水中的杂质去分析解答;
(4)根据洗洁精具有乳化作用进行解答;
解答 解:(1)硫化氢(H2S)是由氢元素和硫元素组成的,根据质量守恒定律,生成硫化氢的物质中要有氢元素和硫元素;
A、糖类主要含有C、H、O三种元素,不含硫元素;故A错误;
B、维生素主要含有C、H、O三种元素,不含硫元素;故B错误;
C、蛋白质可以分解出是氨基酸,氨基酸中含有的元素有C H O N S P,含有S、H两种元素;故C正确;
故选:C;
(2)硝酸铅[Pb(NO3)2]与H2S发生复分解反应,相互交换成分生成硫化铅和硝酸,其反应的化学方程式为:
Pb(NO3)2+H2S=PbS↓+2HNO3;
故答案为:Pb(NO3)2+H2S=PbS↓+2HNO3;
(3)判断硬水还是软水的方法是:取样,加肥皂水,产生泡沫较少且有白色垢状物为硬水,反之为软水;
活性炭具有吸附性,能吸附水中的杂质,故填:吸附;
(4)餐具上的油污可用洗洁精来洗掉,这是利用洗洁精的乳化作用;
故答案为:(1)C (2)Pb(NO3)2+H2S═PbS↓+2HNO3
(3)取样,加肥皂水,产生泡沫较少且有白色垢状物为硬水,反之为软水.吸附
(4)乳化
点评 生活处处有化学,学会用所学的化学知识,解决生活中的实际问题.

练习册系列答案
相关题目
9. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法正确的是( )
向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法正确的是( )
 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法正确的是( )
向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示.下列说法正确的是( )| A. | 取a点溶液,滴加稀盐酸,有白色沉淀 | |
| B. | 若取b~c段固体,滴加稀盐酸,有气泡产生 | |
| C. | c点溶液中的溶质为Zn(NO3)2 | |
| D. | d点时的固体有两种 |
10.化学与我们的生产、生活息息相关,以下说法中,不合理的是( )
| A. | 工业常用铁桶来储运烧碱 | |
| B. | 冬天室内用煤炉取暖要严防煤气中毒,可多撒石灰水避免 | |
| C. | 蒸馏水是纯净物,没有味道 | |
| D. | 将菜刀泡在水中可少生锈 |
7.为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | Cu(CuO) | 氧气 | 通入氧气并加热 |
| D | NaCl溶液(Na2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验操作正确的是( )
| A. |  验证反应放热 | B. |  过滤 | ||
| C. |  稀释浓硫酸 | D. |  验满 |
11.给10%的硫酸溶液通电(实质为电解水,硫酸不发生化学变化)以测定水的组成,下面四组数据是实验后获得的,你认为其中最接近理论值的一组是( )
| 氧气质量(克) | 氢气质量(克) | 硫酸的质量分数 | |
| A | 64 | 8 | 10% |
| B | 10 | 2 | 10% |
| C | 16 | 2 | 11% |
| D | 16 | 32 | 11% |
| A. | A | B. | B | C. | C | D. | D |
8.现有下列装置,回答问题:
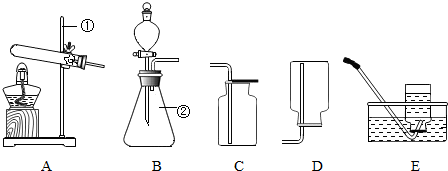
(1)写出有标号仪器的名称:①铁架台,②锥形瓶;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,发生装置为B(填字母序号).若反应过于剧烈,从实验安全角度考虑,可以采取的措施有减缓液体滴加速率(写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验.
【实验内容】
【实验分析】
①完善上表中的填空内容:实验26%、实验3MnO2;
②实验2的目的是与实验1作对比,确定MnO2是否起催化作用;
③经讨论,实验1的结论不正确,理由是可能是分解后产物中其他物质起催化作用;;
【资料】在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+K2Mn4O8+4O2↑
b、KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$KMnO2+O2↑
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为C(填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃一377.9℃范围中的失重率(O2与KMnO4的质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以b(填“a”或“b”)为主.

(1)写出有标号仪器的名称:①铁架台,②锥形瓶;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,发生装置为B(填字母序号).若反应过于剧烈,从实验安全角度考虑,可以采取的措施有减缓液体滴加速率(写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验.
【实验内容】
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g 加入5mL6%的H2O2溶液 | 剧烈反应,放热 产生大量气泡 | 生成物中的MnO2 催化分解H2O2 |
| 2 | 取0.2g MnO2 加入5mL6% (H2O2质量分数)的H2O2溶液 | 平稳反应,放热,持续产生气泡 | MnO2 催化 分解H2O2 |
| 3 | 取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 MnO2 |
①完善上表中的填空内容:实验26%、实验3MnO2;
②实验2的目的是与实验1作对比,确定MnO2是否起催化作用;
③经讨论,实验1的结论不正确,理由是可能是分解后产物中其他物质起催化作用;;
【资料】在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+K2Mn4O8+4O2↑
b、KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$KMnO2+O2↑
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为C(填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃一377.9℃范围中的失重率(O2与KMnO4的质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以b(填“a”或“b”)为主.

