题目内容
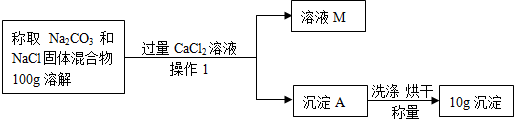
21、在学了盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中质量分数的如下探究实验.

(1)“操作1”的名称是
(2)写出加过量CaCl2反应的化学方程式
(3)溶液M的溶质是

(1)“操作1”的名称是
过滤
;该操作需要用到的铁制仪器是铁架台
.(2)写出加过量CaCl2反应的化学方程式
CaCl2+Na2CO3=CaCO3↓+2NaCl
;确定CaCl2溶液是否过量的方法是静置,向上层清液中继续滴加Na2CO3溶液,若有沉淀说明CaCl2溶液已过量
.(3)溶液M的溶质是
CaCl2、NaCl
;导致测定沉淀的结果偏大的原因可能是沉淀未洗涤干净
.分析:本题考查的是盐的化学性质,是为了测定Na2CO3和NaCl的固体混合物中物质的质量分数而进行的实验探究.操作1中加入过量氯化钙的目的是把碳酸钠充分反应,然后经过过滤操作把固体和液体分离.分离后的固体再洗涤、干燥、称量就可以了.过滤用到的主要仪器有:漏斗、玻璃棒、烧杯和铁架台,还要注意化学方程式的配平.
解答:解:(1)固体和液体分离用过滤的方法,过滤用到的主要仪器有:漏斗、玻璃棒、烧杯和铁架台.故答案为:过滤;铁架台
(2)CaCl2和Na2CO3互相交换成分生成CaCO3白色沉淀和NaCl,要注意化学方程式的配平.要确定CaCl2溶液是否过量,只要向上层清液中继续滴加Na2CO3溶液,若有沉淀说明CaCl2溶液已过量.故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;静置,向上层清液中继续滴加Na2CO3溶液,若有沉淀说明CaCl2溶液已过量.
(3)溶液M的溶质是原来的和新生成的氯化钠,还有过量的氯化钙溶液中的溶质氯化钙;导致测定沉淀的结果偏大的原因可能是沉淀没有洗干净或者是沉淀没有干燥好.故答案为:CaCl2、NaCl;沉淀未洗涤干净(或沉淀干燥不充分)
(2)CaCl2和Na2CO3互相交换成分生成CaCO3白色沉淀和NaCl,要注意化学方程式的配平.要确定CaCl2溶液是否过量,只要向上层清液中继续滴加Na2CO3溶液,若有沉淀说明CaCl2溶液已过量.故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;静置,向上层清液中继续滴加Na2CO3溶液,若有沉淀说明CaCl2溶液已过量.
(3)溶液M的溶质是原来的和新生成的氯化钠,还有过量的氯化钙溶液中的溶质氯化钙;导致测定沉淀的结果偏大的原因可能是沉淀没有洗干净或者是沉淀没有干燥好.故答案为:CaCl2、NaCl;沉淀未洗涤干净(或沉淀干燥不充分)
点评:本考点属于盐的性质中实验方法和过程的探究,根据物质的溶解性和除杂质的条件,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,还要加强记忆除去常用离子的方法,从而突破难点.本考点经常出现在选择题、填空题和实验题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目