题目内容
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。

次数 | 第1次 | 第3次 | 第4次 |
加入盐酸的质量(g) | 20 | 20 | 20 |
剩余固体的质量(g) | 30 | a | 15 |
(1)石灰石样品中CaCO3的质量分数是 。
(2)第3次加入盐酸后,a为 g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)
(1)0.571(57.1%或4/7)
(2)20
(3)0.1825
【解析】
试题分析:由表格可以知道,剩余的固体即为二氧化硅为15g,因为二氧化硅与稀盐酸不反应,所以碳酸钙为20g,质量分数为20比35等于4/7,每次加的盐酸的量都是一样的,所以消耗的碳酸钙也应该是相同的,即每次反应掉5g的碳酸钙,一共有20g碳酸钙,所以第三次共反应掉碳酸钙15g,剩余固体质量为20g,a为20g,根据化学方程式进行计算:
设需要盐酸中HClx mol
CaCO3+2HCl→CaCl2+CO2↑+ H2O
2 1
X 0.2
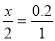
x=0.4mol
0.4×36.5g/mol=14.6g
14.6/80=0.1825
考点:根据化学方程式进行计算

100多种元素能合理地组成庞大数量的物质,应用于我们的日常生活之中。用表中的元素组成适当的物质,回答下列问题:
元素名称 | 碳 | 氧 | 硫 | 氯 | 钠 | 钙 |
元素符号 | C | O | S | Cl | Na | Ca |
(1)请用物质名称或化学式填写:固态时可用于人工降雨的氧化物是 ,会造成酸雨的主要物质是 ,能与血液里的血红蛋白结合,造成人体中毒的气体是 。
(2)光彩夺目的焰火离不开多种元素的焰色反应,表中钠元素的火焰呈 色。
(3)自来水厂应用活性炭、氯气等物质对水进行加工处理,其中活性炭起 作用,氯气的作用是 。

