题目内容
14.完成填空:Fe2O3中铁氧两元素的质量比是7:3 铁元素的质量分数是70%.分析 根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:氧化铁中铁元素、氧元素的质量比为(56×2):(16×3)=7:3.
氧化铁中铁元素的质量分数为:$\frac{56×2}{56×2+16×3}×100%$=70%.
故填:7:3;70%.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
5.王丽同学立志将来做个医生,下面是她设想的一些医疗方法,你认为不可行的是( )
| A. | 在流感发生时,为预防传染,可将教室的门窗关闭,用食醋熏蒸 | |
| B. | 给胃酸过多的人服用含Al(OH)3的药品 | |
| C. | 做胃X光透视的人需口服含硫酸钡的“钡餐”,现将其改为口服碳酸钡 | |
| D. | 预防佝偻病,可服用含钙的葡萄糖酸钙片 |
2.常温下,将下列物质各5g分别溶于95g水中,充分混合,所得溶液中溶质质量分数最小的是( )
| A. | Na2CO3•10H2O | B. | CuSO4 | C. | CaO | D. | SO3 |
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
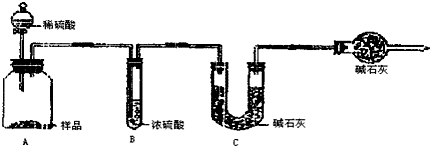
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.

甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
1.下列有关药品取用的说法正确的是( )
| A. | 实验中剩余的药品应该放回原瓶中 | |
| B. | 为避免中毒,不允许闻任何药品的气味 | |
| C. | 当未指明用量时,液体应取最少量即l-2ml | |
| D. | 当未指明用量时,固体应盖满容器底部即可 |

