题目内容
15.在研究某大理石样品(杂质不溶于水也不与盐酸反应)的活动中,兴趣小组同学进行了如下实验.过程如图所示:
求:(1)反应中生成的二氧化碳质量;
(2)该大理石样品中所含碳酸钙的质量分数;
(3)过滤掉杂质后烧杯内的物质质量.
分析 (1)根据质量守恒定律可知烧杯内质量的减少量就是生成二氧化碳的质量;(2)根据二氧化碳的质量算出碳酸钙的质量,再除以样品的质量即可.(3)过滤掉杂质后烧杯内的物质质量=充分反应后烧杯中物质的质量-杂质的质量.
解答 解:(1)根据质量守恒定律,产生CO2的质量的为(12.5g+50g)-58.1g=4.4g
(2)设大理石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}=\frac{44}{4.4g}$,
x=10g
大理石样品中碳酸钙的质量分数为:$\frac{10g}{12.5g}$×100%=80%
答:大理石样品中碳酸钙的质量分数为80%.
(3)过滤掉杂质后烧杯内的物质质量58.1g-(12.5g-10g)=55.6g.
故答案为:(1)4.4g;(2)80%;(3)55.6g.
点评 解答本题的关键是根据质量守恒定律可知烧杯内质量的减少量就是生成二氧化碳的质量,根据二氧化碳的质量再计算碳酸钙的质量即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列各选项与如图所示曲线相符的是( )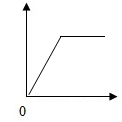

| 选项 | 横 坐 标 | 纵 坐 标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
3.“人造空气”帮助人类实现了“太空漫步”的梦想,其中含有70%的N2、20%以上的O2、还有CO2等.下列有关说法中正确的是( )
| A. | “人造空气”比空气中的氮气含量高 | |
| B. | 燃着的蜡烛在“人造空气”中会熄灭 | |
| C. | “人造空气”若只有O2会更有益于人的呼吸 | |
| D. | 可以利用反应2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,测定“人造空气”中O2的含量 |
20.下列四个图象中,能正确反映对应变化关系的是( )
 |  |  |  |
| A、向一定量铁粉中加入稀盐酸,测定生成氢气的质量 | B、向一定量碳酸钙固体中加入稀盐酸,测定生成气体的质量 | C、向一定量氧化铁固体中加入稀盐酸,测定溶液中铁元素的质量 | D、向一定量氢氧化钠溶液中加入稀盐酸,测定溶液中氢氧化钠的质量 |
| A. | A | B. | B | C. | C | D. | D |
7.下列图象能正确反映其对应关系的是( )

| A. | 向pH=9的溶液中不断加水 | |
| B. | 加热木炭和氧化铜的混合物 | |
| C. | 高温煅烧一定质量的石灰石 | |
| D. | 向FeCl3和HNO3的混合溶液中加入NaOH溶液直至过量 |
4.最早通过定量实验测定空气组成的科学家是( )
| A. | 道尔顿 | B. | 门捷列夫 | C. | 拉瓦锡 | D. | 阿伏加德罗 |
5.自来水厂的净化过程中没有涉及到的净化方法是( )
| A. | 蒸馏 | B. | 吸附 | C. | 过滤 | D. | 沉淀 |