题目内容
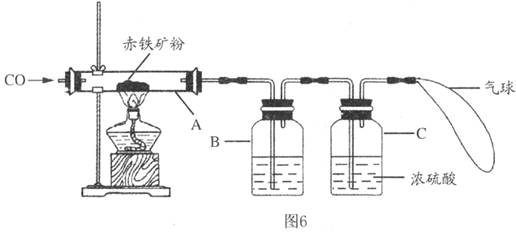
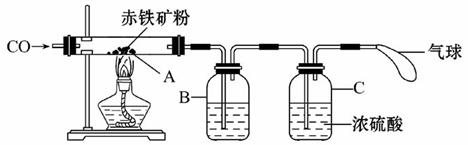
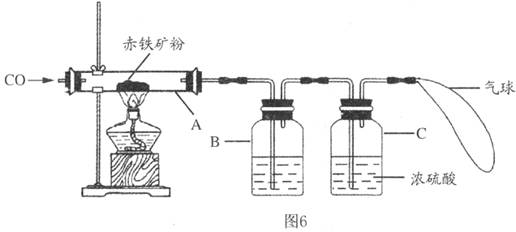
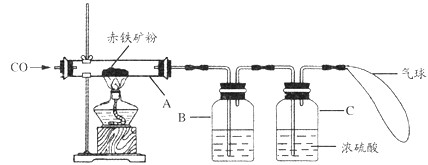
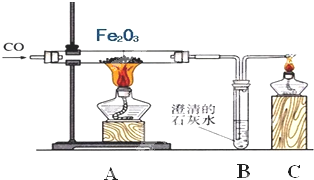 钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(所取赤铁矿的质量为20克)
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(所取赤铁矿的质量为20克)(1)在实验前开始加热应该先
(2)玻璃管中加热时发生的化学反应方程式为
(3)B中石灰水的目的是
(4)在C处放燃着的酒精灯的目的是
(5)充分反应后测定玻璃管中剩余物质的质量为15.2克,则由此可以求出赤铁矿中氧化铁的质量分数为
分析:①根据实验注意事项解答;
②根据一氧化碳还原氧化铁写出化学反应式;
③澄清石灰水可以很好的吸收二氧化碳气体;
④从CO的毒性分析;
⑤根据玻璃管中剩余物质的质量为15.2克,计算出氧化铁的质量,然后根据铁粉样品的总质量计算氧化铁的质量分数.
②根据一氧化碳还原氧化铁写出化学反应式;
③澄清石灰水可以很好的吸收二氧化碳气体;
④从CO的毒性分析;
⑤根据玻璃管中剩余物质的质量为15.2克,计算出氧化铁的质量,然后根据铁粉样品的总质量计算氧化铁的质量分数.
解答:解:①实验前先通往一氧化碳为了排出玻璃管内的空气,防止加热时发生爆炸;实验结束后,先停止加热防止被还原出来的铁在温度较高的情况下遇到空气中的氧气容易重新被氧化;
②一氧化碳还原氧化铁写出化学反应式:3CO+Fe2O3
2Fe+3CO2;
③为检验和吸收生成的二氧化碳;
④点燃余下的一氧化碳,防止污染空气;
⑤对于玻璃管来说减小的质量即是氧化铁中氧元素的质量,所以可设纯净的氧化铁的质量是X,则有:X×
=20g-15.2g,解得x=16g,所以则赤铁矿粉末中Fe2O3的质量分数:
×100%═80%.
故答案为:通入一氧化碳;停止加热;3CO+Fe2O3
2Fe+3CO2;“炼”得的铁不含碳,工业上的生铁含有碳;检验和吸收生成的二氧化碳;点燃余下的一氧化碳,防止污染空气;80%.
②一氧化碳还原氧化铁写出化学反应式:3CO+Fe2O3
| ||
③为检验和吸收生成的二氧化碳;
④点燃余下的一氧化碳,防止污染空气;
⑤对于玻璃管来说减小的质量即是氧化铁中氧元素的质量,所以可设纯净的氧化铁的质量是X,则有:X×
| 3×16 |
| 3×16+2×56 |
| 16g |
| 20g |
故答案为:通入一氧化碳;停止加热;3CO+Fe2O3
| ||
点评:本题通过一氧化碳还原氧化铁的反应,考查相关化学反应式的书写、实验注意事项和计算,要同学们具有综合的化学知识,才可做好此题.

练习册系列答案
相关题目