题目内容
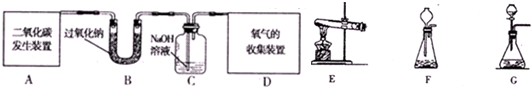
过氧化钠(Na2O2),是一种淡黄色固体,它能与二氧化碳反应生成氧气,也能与水反应生成氧气,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,某学生为了验证“过氧化钠与二氧化碳反应生成氧气”这一实验,以大理石、足量的盐酸和过氧化钠为原料制取O2,设计出如下图所示实验装置:
(1)A是制取CO2的装置,应从下列图甲、图乙、图丙中选择_________________。
(2)B装置的作用是吸收A装置中产生的盐酸酸雾,D装置的作用是_____________。
(3)用H装置收集生成的气体,则气体应从_________(填写a或b)进入H装置;为了检验H中收集到的气体,气体收集完毕后,可以用_________的木条伸入集气瓶内,木条会________________。
(4)若F装置中的石灰水出现很少量的白色浑浊现象,这是因为____________。
(5)表明E中的过氧化钠样品接近反应完毕时的现象是____________。
(6)G装置的作用是_________________。
(7)当观察到何种现象时,才能证明:“过氧化钠与二氧化碳反应生成氧气”?
答案:
解析:
提示:
解析:
| (1)图乙。
(2)检验经过C装置的气体中是含有水蒸气。 (3)b,带火星,立即复燃。 (4)有少量二氧化碳没有与过氧化钠完全反应。 (5)F装置中的石灰水出现大量的白色浑浊现象时: (6)吸收没有与过氧化钠完全反应的二氧化碳,得到较纯净的氧气。 (7)答:D中白色粉末不变色,H中的气体能使带火星的木条复燃:则可证明:“过氧化钠与二氧化碳反应生成氧气”。
|
提示:

练习册系列答案
相关题目