题目内容
17.将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤液和滤渣,可能有下列情况:(1)若滤液为蓝色,则滤渣中一定有银(或Ag),滤液中一定含有的金属阳离子是Zn2+、Cu2+;
(2)若向所得滤液中滴加稀盐酸,有白色沉淀生成,则滤液中一定含有的溶质是Zn(NO3)2、Cu(NO3)2、AgNO3.(填化学式)
分析 根据三种金属的活动性由强到弱的顺序:锌>铜>银,依据实验现象“得到蓝色溶液”,判断铜、锌混合物与硝酸银充分反应的结果分析滤渣和滤液的成分;根据滤液滴加稀盐酸,有白色沉淀生成,说明有硝酸银,据此分析滤液中的溶质.
解答 解:(1)由得到溶液呈蓝色,说明铜粉与硝酸银发生了反应,反应后溶液中一定含有硝酸铜;由于锌的活动性比铜强,锌会先于铜与硝酸银反应且锌粉可与硝酸铜反应,因此可判断锌粉已完全反应,溶液中一定含有硝酸锌;硝酸银是否完全反应则成为所要猜测的两种可能,若硝酸银完全反应,则溶液中只含有硝酸锌、硝酸铜,若硝酸银有剩余,则溶液中含有硝酸锌、硝酸铜、硝酸银;因此滤渣中一定含有银,一定没有锌,可能含有铜;滤液中一定含有硝酸锌、硝酸铜,可能含有硝酸银;故答案为:银(或Ag);Zn2+、Cu2+;
(2)若向所得滤液中滴加稀盐酸,有白色沉淀生成,说明硝酸银有剩余,结合(1)的推断,因此利用中的溶质一定含有硝酸锌、硝酸铜和硝酸银;故答案为:Zn(NO3)2、Cu(NO3)2、AgNO3.
点评 本题考查了金属的活动性顺序的运用,活动性强的金属放入活动性弱的金属的混合盐溶液中,活动性强的金属会先把活动性最弱的金属从其盐溶液中置换出来,然后再置换活动性较弱的金属.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
2.下列变化中,属于化学变化的是( )
| A. | 苹果榨汁 | B. | 面包生霉 | C. | 冰雪融化 | D. | 蔗糖溶于水 |
6.下列能量转换过程中,能量主要是由化学变化产生的是( )
| A. | 蜡烛照明 | B. | 水力发电 | C. | 太阳能供热 | D. | 电热器取暖 |
3.镁原子的结构示意图如图所示,对镁原子的说法错误的是( )
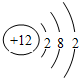

| A. | 核电荷数为12 | |
| B. | 该元素在元素周期表中处在第三周期 | |
| C. | 带12个单位正电荷 | |
| D. | 在化学反应中,易失去最外层的2个电子 |