题目内容
金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如下表所示:

它们的金属活动性由强到弱的顺序为
[ ]
A.
X Mn Y Ni Z
B.
Z Ni Y Mn X
C.
Z Mn Y Ni X
D.
X Mn Ni Y Z
答案:A
解析:
解析:
|
讲析:由于金属Ni、Mn在金属活动顺序表中没有出现,所以部分学生感觉此题很难.其实不然,根据金属和化合物溶液(即盐溶液)的反应规律即可解答.在金属活动顺序表中,排在前面的金属能把排在后面的金属从它的化合物溶液中置换出来.将Ni分别放入其他三种金属X、Y、Z的盐溶液中,只有Z盐溶液中有金属析出,说明Ni比Z的金属活动性强且X、Y比Ni的金属活动性强.然后我们和选项进行对比,可知B、C选项错误.将Mn分别放入其他三种金属X、Y、Z的盐溶液中,Y、Z的盐溶液中有金属析出,说明Mn的金属活动性强于Y、Z且X的金属活动性强于Mn.综上所述,可以得出金属活动性顺序为X>Mn>Y>Ni>Z.因此A选项正确. 点评:本题以金属活动性顺序表中未出现的元素为载体,考查学生的知识迁移能力,这也是本题的难点. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
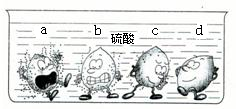 学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是
(2)将金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如右表所示.则它们的金属活动性由强到弱的顺序为(
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
B.Z Ni Y Mn X
C.X Mn Y Ni Z
D.X Mn Ni Y Z
(3)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.请你写出下列用金属氧化物制取金属的化学方程式:
①金属氧化物加热分解:
②用碳还原金属氧化物:
(4)查阅资料:在金属活动性顺序里,位于氢后面的金属铜在常温下虽然不能与稀盐酸、
稀硫酸反应,但可以与浓硫酸在加热时发生反应,其反应的化学方程式为:
Cu+2H2SO4(浓)?CuSO4+SO2↑+2H2O
反应生成的SO2是一种无色、能溶于水、有刺激性气味的气体.若用该方法制取硫酸铜,应用
(5)请你利用所学知识设计一种以铜、稀硫酸为主要原料制取硫酸铜的方法.(用化学方程式表示)
(6)向12.8g铜中加入40g浓硫酸溶液,恰好完全反应,计算生成SO2的质量(方程式见上)和反应前硫酸溶液中溶质的质量分数.
7、金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如下表所示.
|
(2012?临沂模拟)金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如下表所示.
|