题目内容
【提出问题】上述酚酞试液变红、红色又消失的原因是什么?
【作出猜想】
小李:可能是个偶然现象。
小王:可能是浑浊液中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色。
小胡:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的二氧化碳反应的缘故。 小翠:可能是在热水中氢氧化镁的溶解度大,溶液中OH-离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH-离子变少,酚酞试液又变无色。
1.【讨论交流】
(1)对小李猜想“是个偶然现象”,四位同学都认为可以用科学探究的一般方法排除偶然现象。他们的方法是: 。
(2)小胡认为小王的猜想不正确,她从碱使酚酞试液变色的原因上给予了否定:
2.【实验验证】
(1)四位同学讨论后认为要验证小胡的猜想,还需做如下实验,你知道其实验的目的吗?


(2)固体Mg(OH)2不能在水中电离出OH-,不能使酚酞变红。


 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.(一)某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水.
【猜想】(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液.
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
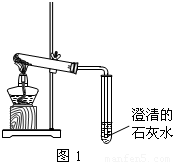
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
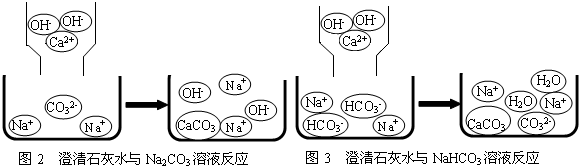
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3).请写出Na2CO3与澄清石灰水发生反应的化学方程式
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是
【拓展应用】(1)固体Na2CO3中混有少量NaHCO3,可通过
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的
(二)实验室里同学们正在进行探究实验.用A、B、C、D四支试管各取室温下等体积的氢氧化钙饱和溶液,再向A试管中滴加碳酸钠溶液、B试管中滴加氯化铜溶液、C试管中滴加氯化铵溶液、D试管中滴加氯化钠溶液,振荡.
【提出问题】:他们在探究的问题是氢氧化钙能否与
【表达与交流】:①阳阳同学根据在D试管中没有看到明显现象,判断D试管中无化学反应发生.你认为此判断的依据是否合理
②为科学处理实验过程中产生的废液,同学们对B试管中反应后过滤得到的无色滤液,继续进行探究.阳阳同学猜想滤液中只含有一种溶质,娇娇同学猜想滤液中含有两种溶质.为验证哪位同学的猜想是正确的,同学们选用两种不同类别的物质进行以下两个实验.请填写下列实验报告:
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中 |
娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 | |
| 方案二:取少量滤液加入试管中,向其中 |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议(三)现有CaCO3 和KHCO3的混合物,甲、乙两同学分别称取一定质量的该混合物来判定其中两种成分的质量比.
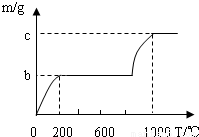
①甲同学称取2.00g混合物,向其中加入过量的盐酸,生成气体的质量为ag,则a=
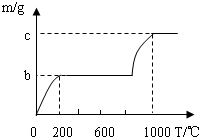
②已知KHCO3 和NaHCO3一样加热易分解,K2CO3的分解温度远高于1000℃.乙同学称取Wg混合物充分加热,所得CO2气体质量(m) 随温度(T)变化的曲线如图所示,则m(CaCO3):m(KHCO3)═
现有四位同学在探究碱的性质时发现氢氧化钠、氢氧化钙等可溶性碱都能使酚酞试液变红。他们想进一步探究:不溶性的氢氧化镁是否也能使酚酞试液变红。为此,他们将适量的氢氧化镁加入到盛有热水的烧杯中搅拌,然后向浑浊的液体中滴加酚酞试液,发现酚酞试液变红,可是过一会儿红色又消失了。
【提出问题】上述酚酞试液变红、红色又消失的原因是什么?
【作出猜想】小李:可能是个偶然现象。
小王:可能是浑浊液中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色。
小胡:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的二氧化碳反应的缘故。
小翠:可能是在热水中氢氧化镁的溶解度大,溶液中OH一离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH一离子变少,酚酞试液又变无色。
【讨论交流】(1)对小李猜想“是个偶然现象”,四位同学都认为可以用科学探究的一般方法排除偶然现象。他们的方法是: 。
(2)小胡认为小王的猜想不正确,她从碱使酚酞试液变色的原因上给予了否定:
【实验验证】(1)四位同学讨论后认为要验证小胡的猜想,还需做如下实验,你知道其实验的目的吗?
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油。 |
(2)小翠设计了如下对比实验方案证明自己的猜想,请将其方案补充完整。
| 实验方法 | 可能观察到的现象 | 结论 |
| 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
【反思提高】将氢氧化镁加入到热水中搅拌,所得溶液的pH 7(填“<”、“>”、“=”);冷却后pH 。(填“变大”、“变小”或“不变”)
现有四位同学在探究碱的性质时发现氢氧化钠、氢氧化钙等可溶性碱都能使酚酞试液变红。他们想进一步探究:不溶性的氢氧化镁是否也能使酚酞试液变红。为此,他们将适量的氢氧化镁加入到盛有热水的烧杯中搅拌,然后向浑浊的液体中滴加酚酞试液,发现酚酞试液变红,可是过一会儿红色又消失了。
【提出问题】上述酚酞试液变红、红色又消失的原因是什么?
【作出猜想】小李:可能是个偶然现象。
小王:可能是浑浊液中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色。
小胡:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的二氧化碳反应的缘故。
小翠:可能是在热水中氢氧化镁的溶解度大,溶液中OH一离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH一离子变少,酚酞试液又变无色。
【讨论交流】(1)对小李猜想“是个偶然现象”,四位同学都认为可以用科学探究的一般方法排除偶然现象。他们的方法是: 。
(2)小胡认为小王的猜想不正确,她从碱使酚酞试液变色的原因上给予了否定:
【实验验证】(1)四位同学讨论后认为要验证小胡的猜想,还需做如下实验,你知道其实验的目的吗?
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油。 |
(2)小翠设计了如下对比实验方案证明自己的猜想,请将其方案补充完整。
| 实验方法 | 可能观察到的现象 | 结论 |
| 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
【反思提高】将氢氧化镁加入到热水中搅拌,所得溶液的pH 7(填“<”、“>”、“=”);冷却后pH 。(填“变大”、“变小”或“不变”)
(一)某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水.
【猜想】(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液.
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3).请写出Na2CO3与澄清石灰水发生反应的化学方程式______;写出NaHCO3与澄清石灰水混合时参与反应的离子:______.
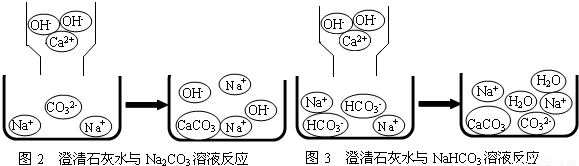
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到______现象来鉴别Na2CO3和NaHCO3溶液的.至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究.
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是______;根据你分析:Na2CO3受热______分解(填“易”或“不易”).在加热NaHCO3固体时,丙同学观察到的实验现象是______(任写一种).
【拓展应用】(1)固体Na2CO3中混有少量NaHCO3,可通过______方法除去.
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的______溶液.
(二)实验室里同学们正在进行探究实验.用A、B、C、D四支试管各取室温下等体积的氢氧化钙饱和溶液,再向A试管中滴加碳酸钠溶液、B试管中滴加氯化铜溶液、C试管中滴加氯化铵溶液、D试管中滴加氯化钠溶液,振荡.
【提出问题】:他们在探究的问题是氢氧化钙能否与______(选填“酸”、“碱”、“盐”)发生反应?
【表达与交流】:①阳阳同学根据在D试管中没有看到明显现象,判断D试管中无化学反应发生.你认为此判断的依据是否合理______ (填“合理”或“不合理”),并解释其原因是______;
②为科学处理实验过程中产生的废液,同学们对B试管中反应后过滤得到的无色滤液,继续进行探究.阳阳同学猜想滤液中只含有一种溶质,娇娇同学猜想滤液中含有两种溶质.为验证哪位同学的猜想是正确的,同学们选用两种不同类别的物质进行以下两个实验.请填写下列实验报告:
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
(三)现有CaCO3 和KHCO3的混合物,甲、乙两同学分别称取一定质量的该混合物来判定其中两种成分的质量比.
①甲同学称取2.00g混合物,向其中加入过量的盐酸,生成气体的质量为ag,则a=______.该同学能否由气体质量计算出混合物中两成分的质量比?______(填“能”或“不能”)
②已知KHCO3 和NaHCO3一样加热易分解,K2CO3的分解温度远高于1000℃.乙同学称取Wg混合物充分加热,所得CO2气体质量(m) 随温度(T)变化的曲线如图所示,则m(CaCO3):m(KHCO3)═______(用含b、c的代数式表示)