题目内容
海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钾等.综合利用海水制备金属镁的流程如下图所示: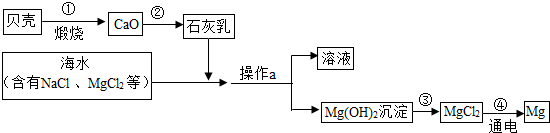
(1)操作a的名称是
(2)图中反应①、②、③、④属于分解反应的是
(3)工业冶炼镁常用电解MgCl2的方法,反应为:MgCl2
| ||
(4)写出第③步反应的化学方程式:
分析:(1)过滤是分离固液混合物的常用的操作方法,该操作后可得到溶液和固体;根据操作需要,判断完成该操作需要的玻璃仪器;
(2)根据反应物和生成物可确定反应物的类型;
(3)根据质量守恒定律及化学方程式书写要求,分析电解氯化镁的生成物并写成反应的化学方程式;
(4)根据碱类物质的性质及变化规律,可判断反应③为氢氧化镁与盐酸的反应.
(2)根据反应物和生成物可确定反应物的类型;
(3)根据质量守恒定律及化学方程式书写要求,分析电解氯化镁的生成物并写成反应的化学方程式;
(4)根据碱类物质的性质及变化规律,可判断反应③为氢氧化镁与盐酸的反应.
解答:解:(1)根据操作a完成后得到溶液和氢氧化镁的固体沉淀物,可判断操作a为过滤操作;该操作过程中除使用烧杯、玻璃棒外,还需要使用玻璃仪器漏斗,故答案为:过滤,漏斗;
(2)①碳酸钙高温煅烧属于分解反应,②氧化钙与水反应生成氢氧化钙属于化合反应,③氢氧化镁与盐酸反应属于复分解反应,④氯化镁点解生成镁和氯气属于分解反应,故答案为:①④;
(3)氯化镁电解除生成镁外,还应生成单质气体氯气,故答案为Cl2;
(4)氢氧化镁能与盐酸反应生成氯化镁和水,故答案为:Mg(OH)2+2HCl=MgCl2+2H2O;
(2)①碳酸钙高温煅烧属于分解反应,②氧化钙与水反应生成氢氧化钙属于化合反应,③氢氧化镁与盐酸反应属于复分解反应,④氯化镁点解生成镁和氯气属于分解反应,故答案为:①④;
(3)氯化镁电解除生成镁外,还应生成单质气体氯气,故答案为Cl2;
(4)氢氧化镁能与盐酸反应生成氯化镁和水,故答案为:Mg(OH)2+2HCl=MgCl2+2H2O;
点评:利用流程图分析利用海水制备金属镁的流程,明确流程中所进行的操作和发生的反应,这是解决问题的基本方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目




