题目内容
如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验。
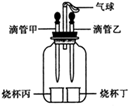
(1)若滴管甲中吸有水,烧杯丙中盛有适量生石灰。将滴管甲中的水滴入烧杯丙中,可观察到气球鼓起,一段时间后装置恢复原状。利用所学化学知识解释气球鼓起的原因是 ,烧杯丙中发生反应的化学方程式为 。
(2)若烧杯丁中盛有适量锌粒,将滴管乙中的液体滴入烧杯丁中,烧杯丁中有气泡生成,气球明显鼓起,则滴管乙中所装液体是 ,烧杯丁中发生反应的化学方程式为 。
(3)若滴管甲中吸有稀硫酸,滴管乙中吸有水,烧杯丙中盛有适量小苏打,烧杯丁中盛有用石蕊溶液染成的紫色干燥纸花。该实验可用于验证使石蕊变色的物质是碳酸而不是二氧化碳。正确的操作顺序是:先 ,观察 ;再 。
(4)若在丙烧杯中盛有40g溶质质量分数为10%的NaOH溶液,将稀H2SO4通过滴管甲滴入烧杯丙中至恰好完全反应。求:参加反应的NaOH溶液中溶质的质量和反应生成Na2SO4的质量分别为多少克?

(1)若滴管甲中吸有水,烧杯丙中盛有适量生石灰。将滴管甲中的水滴入烧杯丙中,可观察到气球鼓起,一段时间后装置恢复原状。利用所学化学知识解释气球鼓起的原因是 ,烧杯丙中发生反应的化学方程式为 。
(2)若烧杯丁中盛有适量锌粒,将滴管乙中的液体滴入烧杯丁中,烧杯丁中有气泡生成,气球明显鼓起,则滴管乙中所装液体是 ,烧杯丁中发生反应的化学方程式为 。
(3)若滴管甲中吸有稀硫酸,滴管乙中吸有水,烧杯丙中盛有适量小苏打,烧杯丁中盛有用石蕊溶液染成的紫色干燥纸花。该实验可用于验证使石蕊变色的物质是碳酸而不是二氧化碳。正确的操作顺序是:先 ,观察 ;再 。
(4)若在丙烧杯中盛有40g溶质质量分数为10%的NaOH溶液,将稀H2SO4通过滴管甲滴入烧杯丙中至恰好完全反应。求:参加反应的NaOH溶液中溶质的质量和反应生成Na2SO4的质量分别为多少克?
(1)生石灰与水反应放出大量热导致装置内气体体积膨胀,CaO+H2O=Ca(OH)2
(2)稀硫酸,Zn+H2SO4=ZnSO4+H2↑(或其它合理答案)
(3)将滴管甲中的稀硫酸滴入烧杯丙中 烧杯丁中的纸花是否变色 将滴管乙中的水滴入烧杯丁中(观察烧杯丁中的纸花是否变色)
(4)4g; 7.1g。
(2)稀硫酸,Zn+H2SO4=ZnSO4+H2↑(或其它合理答案)
(3)将滴管甲中的稀硫酸滴入烧杯丙中 烧杯丁中的纸花是否变色 将滴管乙中的水滴入烧杯丁中(观察烧杯丁中的纸花是否变色)
(4)4g; 7.1g。
试题分析:(1)由于生石灰能和水反应,且会放出大量的热,故能使装置内的气体受热膨胀,从而使气球鼓起;生石灰与水反应生成熟石灰,故反应的化学方程式为CaO+H2O=Ca(OH)2。
(2)由于锌是氢前的活泼金属,故能与酸反应生成氢气,从而使装置内压强增大,使气球明显鼓起,所以滴管乙中可以是稀酸(如稀硫酸),锌和稀硫酸反应,生成硫酸锌和氢气,所以烧杯丁中反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。
(3)根据题意,要验证使石蕊变色的物质是碳酸而不是二氧化碳,应先滴加稀硫酸与小苏打反应产生二氧化碳,会发现石蕊溶液染成的紫色干燥纸花不变色;然后再滴加水会变红色,说明二氧化碳与水反应生成碳酸,是碳酸使石蕊溶液变红。
(4)参加反应的NaOH溶液中溶质的质量=40g×10%=4g;
解,设反应生成Na2SO4的质量为x。
2NaOH+ H2SO4=Na2SO4+2H2O
80 142
4g x
80:142=4g:x
解得x=7.1g
答:参加反应的NaOH溶液中溶质质量为4g,生成Na2SO4的质量为7.1g。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目