题目内容
3. 如图所示,大试管中是螺旋状光亮的铁丝,把试管倒插到水中放置一段时间,观察到铁丝表面有生成,试管内水面将上升,产生现象的原因是铁与氧气、水等物质反应使试管内压强减小.
如图所示,大试管中是螺旋状光亮的铁丝,把试管倒插到水中放置一段时间,观察到铁丝表面有生成,试管内水面将上升,产生现象的原因是铁与氧气、水等物质反应使试管内压强减小.
分析 铁生锈的条件是:与氧气接触,有水参加.铁生锈了,消耗了氧气,导致了试管内气压降低,大气压将水压入试管中.
解答 解:
试管内的铁丝与氧气和水充分接触,容易生锈.铁生锈的过程中铁与O2、水等物质反应,使试管内压强减小,从而使得水面上升.
故答案为:上升; 铁与氧气、水等物质反应使试管内压强减小.
点评 熟记铁生锈的条件,另外,空气中氧气减少了,气压降低,外界大气压会用水来填补.

练习册系列答案
相关题目
4.工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:
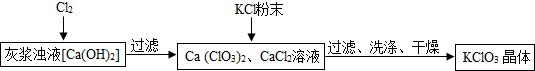
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是相同温度下,氯酸钾的溶解度小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):
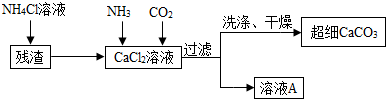
(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaClO3 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):

(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
18.下列化学反应属于置换反应的是( )
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe2O3+6HCl═2FeCl3+3H2O | D. | SO2+2NaOH═Na2SO3+H2O |

 A~E均为初中化学常见物质,A、B、C、D、E均含有同一种元素,B常用于改良酸性土壤.它们之间的相互转化关系如图所示:(图中“→”表示物质间存在转化关系,部分生成物已略去).请回答下列问题:
A~E均为初中化学常见物质,A、B、C、D、E均含有同一种元素,B常用于改良酸性土壤.它们之间的相互转化关系如图所示:(图中“→”表示物质间存在转化关系,部分生成物已略去).请回答下列问题: 某化学兴趣小组同学做粗盐提纯实验,并用所得精盐配置100g溶质质量分数为5%的溶液,其实验过程如下:
某化学兴趣小组同学做粗盐提纯实验,并用所得精盐配置100g溶质质量分数为5%的溶液,其实验过程如下: