题目内容
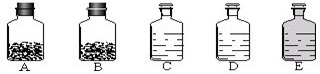
小孟同学为除去NaCl固体中混有的少量Na2SO4、CaCl2 设计了如图所示的实验方案.
请完成下列问题.
(1)写出物质B的名称: .
(2)沉淀D的成分是 .(填化学式)
(3)请写出反应①的化学方程式 ,该反应属 反应(填反应类型).
(4)反应③中如果加入了过量的稀盐酸,对所得氯化钠固体的纯度 (填“有”或“没有”)影响.
【答案】分析:根据除去NaCl固体中混有的少量Na2SO4、CaCl2,先加入过量氯化钡,目的是除去硫酸钠,反应生成硫酸钡沉淀;然后加入过量碳酸钠溶液,目的是除去氯化钙和氯化钡而生成碳酸钙和碳酸钡沉淀以及盐酸具有挥发性进行解答.
解答:解:除去NaCl固体中混有的少量Na2SO4、CaCl2,先加入过量氯化钡,目的是除去硫酸钠,反应生成硫酸钡沉淀;然后加入过量碳酸钠溶液,目的是除去氯化钙和氯化钡而生成碳酸钙和碳酸钡沉淀.
(1)物质B的名称是碳酸钠;
(2)加入过量碳酸钠溶液,目的是除去氯化钙和氯化钡,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,所以沉淀D的成分是碳酸钙和碳酸钡;
(3)反应①是氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;该反应属于复分解反应;
(4)反应③中如果加入了过量的稀盐酸,盐酸具有挥发性,所以对所得氯化钠固体的纯度没有影响.
故答案为:(1)碳酸钠;(2)CaCO3、BaCO3;(3)Na2SO4+BaCl2=BaSO4↓+2NaCl;复分解;(4)没有.
点评:通过回答本题知道了混合物分离的方法和除去可溶性杂质的方法,不能引入新的杂质,并且注意顺序.
解答:解:除去NaCl固体中混有的少量Na2SO4、CaCl2,先加入过量氯化钡,目的是除去硫酸钠,反应生成硫酸钡沉淀;然后加入过量碳酸钠溶液,目的是除去氯化钙和氯化钡而生成碳酸钙和碳酸钡沉淀.
(1)物质B的名称是碳酸钠;
(2)加入过量碳酸钠溶液,目的是除去氯化钙和氯化钡,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,所以沉淀D的成分是碳酸钙和碳酸钡;
(3)反应①是氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;该反应属于复分解反应;
(4)反应③中如果加入了过量的稀盐酸,盐酸具有挥发性,所以对所得氯化钠固体的纯度没有影响.
故答案为:(1)碳酸钠;(2)CaCO3、BaCO3;(3)Na2SO4+BaCl2=BaSO4↓+2NaCl;复分解;(4)没有.
点评:通过回答本题知道了混合物分离的方法和除去可溶性杂质的方法,不能引入新的杂质,并且注意顺序.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目