题目内容
【题目】(8分)请结合下图回答问题:

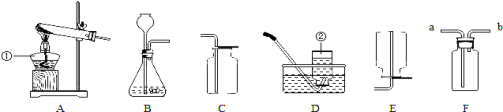
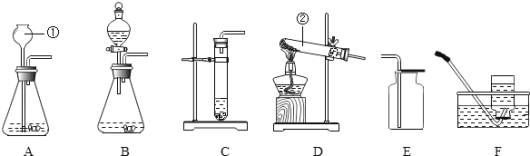
![]() (1)标号①②的仪器名称:① ,② 。
(1)标号①②的仪器名称:① ,② 。
(2)实验室选用A、D装置制取O2,气体收集完毕时,应先 (填“从水中取出导气管”或“熄灭酒精灯”)。
(3)实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3,应选择发生装置为 (选填序号)。
(4)选择发生装置B和收集装置 (选填序号)可以用于实验室制取CO2,若将发生装置由B改为F,其优点是 。
①为了得到纯净、干燥的CO2,除去其中的氯化氢和水,装置(如图)的导管按气流方向连接顺序是4→3→1→2。请用化学反应方程式表示饱和NaHCO3溶液的作用 。

②写出检验CO2的化学反应方程式 。
【答案】(1)①铁架台 ②长颈漏斗
(2)从水中取出导气管。
(3)A
(4)C 控制反应的发生和停止(意思相近的其它答案均给分)。
①NaHCO3 + HCl = NaCl + H2O + CO2↑
②CO2 + Ca(OH)2 = CaCO3↓+ H2O
【解析】
试题分析:(2)A装置属固固加热型,D装置是排水法收集氧气,用排水法收集满氧气后要先把导管移出水槽再熄灭酒精灯,目的是防止水倒流入试管中使试管炸裂;
(3)根据反应物的状态和反应条件选择发生装置,用(NH4)2SO4固体和熟石灰混合加热制取NH3,属固固加热型,选A装置;
(4)实验室用石灰石和稀盐酸制取二氧化碳,属固液在常温下的反应,选B装置,二氧化碳的密度比空气大,易溶于水,故只能用向上排空气法收集,选C装置;F装置可将石灰石放在隔板上,当不需要反应时可用止水夹夹住橡皮管,那么U型管中的压强变大,稀盐酸会进入长颈漏斗中,固体和液体分离,该装置能控制反应的发生和停止;
①要得到纯净、干燥的CO2,要先除杂再干燥,故要先把混合气体通过饱和的碳酸氢钠溶液中把氯化氢气体除去,再通过浓硫酸把水蒸汽除去;
②二氧化碳能使澄清的石灰水变浑浊,故实验室用澄清的石灰水来检验二氧化碳:CO2 + Ca(OH)2 = CaCO3↓+ H2O。

 阅读快车系列答案
阅读快车系列答案【题目】(19分)金属材料在生产、生活中的应用非常广泛。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的 (填序号)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的 和 发生化学反应的过程。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其目的是 。
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(4)金属是一种重要的材料,人类的生活和生产都离不开金属。下表表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
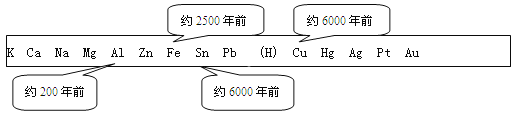
根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列 有关。
①地壳中金属元素的含量;
②金属的导电性;
③金属的活动性;
④金属的延展性;
⑤金属冶炼的难易程度。
(5)实验室有锌片、铁片、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液和硫酸铜溶液7种物质,小红选择合适的物质,设计了以下三种方法对锌、铜、铁的金属活动性顺序进行验证。
①方法一所选用的3种物质是 、硫酸锌溶液和硫酸铜溶液。
②方法二所选用的3种物质是锌片、铜片和 。
③方法三所选用4种物质是锌片、铁片、铜片和 。
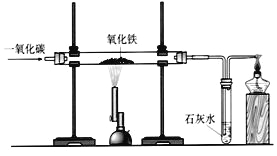
(6)炼铁的原理是利用一氧化碳与氧化铁反应,其反应的化学方程式为 。在实验室里,可用下图所示装置进行实验:实验中玻璃管内的粉末由红色色变黑色,红色粉末氧化铁中的铁元素的化合价为 。
(7)某钢铁厂每天需消耗5 000 t含Fe2O3 80%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁 t。(计算结果保留1位小数)
(8)某兴趣小组的同学对一批铁的样品(含有杂质,杂质不溶与水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中一位同学所用的稀硫酸与铁样品恰好完全反应,实验数据如表:
甲 | 乙 | 丙 | |
烧杯+稀硫酸的质量 | 200 | 150 | 150 |
加入铁的样品的质量 | 9 | 9 | 14 |
充分反应后,烧杯+剩余物的质量 | 208、7 | 158、7 | 163、7 |
请你认真分析数据,回答下列问题:
① 同学所用的稀硫酸与铁的样品恰好完全反应?
②计算铁的样品中铁的质量分数。(写出详细的计算过程)
【题目】在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 4 | 1 | 42 | 10 |
反应后质量(g) | 待测 | 20 | 6 | 31 |
完全反应后,甲的“待测”值应为
A.10 B.8 C.4 D. 0