��Ŀ����
һ�ֽС���ˮ�������ʡ�ÿ������ˮ�������������϶��������������ӵ�Сˮ�Σ��ɷ�95�����ǡ�ʪˮ���������ն�����̼����������ͨˮ��3��������������ȷ����( )
A. ����ˮ���Ǵ����� B. ����ˮ�����ǡ��ɱ������������˹�����
C. ����ˮ����Ӧ�������ڻ�������ЧӦ D. ����ˮ���е�����ֹͣ�˶�
C ��������������ѧ֪ʶ��������Ϣ֪��A�� ����ˮ�����Ǵ�������ڻ���B������ˮ�����ǡ��ɱ������ɱ��������˹����꣬��B����C����ˮ���ն�����̼����������ͨˮ��3���� ����ˮ����Ӧ�������ڻ�������ЧӦ����C��ȷ��D������ˮ���е������ڲ�ͣ���˶�����D���� �㾦�øɱ���ˮ�����ֲ�ͬ�����ʡ��ɱ��ǹ��������̼����ˮ��һ�ֻ������ն�����̼����������ͨˮ�ߣ����Ի�������ЧӦ��... Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д���ȤС��������ṩ���Լ�:ϡ���ᡢ����ʯ��ˮ���Ȼ�����Һ������ͭ��Һ����ɫʯ����Һ��̽������ε����ʡ�С��ͬѧ���Ȼ�����Һ���뵽ϡ������û�й۲쵽���������������Һ����һ��ʱ���������ŵ��̼�����ζ��
[�������]�̼�����ζ��������ʲô?
[���������]����1.�����Ƕ������� ����2.�������Ȼ���
����3.�����ǰ���
������ۺ���Ϊ����3��������������_____________________��
[��������] SO2��CO2�Ļ�ѧ�������ƣ�����ʹ�����ˮ����ǡ�д������������������Ƶķ�Ӧ�Ļ�ѧ����ʽ:____________________________��
[ʵ��̽��]��ͼ��ʾ��С�Ͻ�����������ͨ����ɫʯ����Һ�У��۲쵽_________����������Ϊ����2��ȷ��
[������Ľ�]С����ΪС�ϵĽ��۲���ѧ�������������ṩ���Լ�ͨ��ʵ��ȷ���˲���2��ȷ��
ʵ����� | ʵ������ |
��ͼ��ʾ��������������________________ | _____________________ |
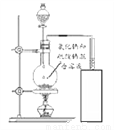
[����]�����Ȼ���������Ļ����Һ�õ����������Ȼ���
[��չӦ��]ʵ���ҿ����Ȼ��ƺ����ᷴӦ��ȡ�Ȼ������壬��֪�Ȼ������弫������ˮ�����Ʋ�ʵ������ȡ�Ȼ������������˵ķ���Ϊ________________(�����)��
A.�����Ȼ�����Һ��ϡ����Ļ���� B.�����Ȼ��ƹ����ϡ����Ļ����
C.�����Ȼ��ƹ����Ũ����Ļ����
��Ӧ����û�е�Ԫ�أ����������ɰ��� SO2+Ca(OH)2=CaSO3��+H2O ��Һ��� ͨ�����ʯ��ˮ�� ���������� C ��������[���������]���������غ㶨�ɿ�֪����Ӧǰ��Ԫ�ص�����䣬��Ӧ����û�е�Ԫ�أ����������ɰ����� [��������]SO2��CO2�Ļ�ѧ�������ƣ�����ʹ�����ˮ����ǡ�����������������Ƶķ�Ӧ����������ƺ�ˮ����ѧ����ʽΪSO2+Ca(OH)2=CaSO...


 ��
�� ��
�� ��ʾ�����Ӷ���������
��ʾ�����Ӷ��������� 6ZnO+4Fe3O4+O2����3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2����3ZnO+2Fe3O4+H2O 3ZnFe2O4+H2��
3ZnFe2O4+H2�� 3MgH2+MgCu2
3MgH2+MgCu2