��Ŀ����
��ȡNaCl��BaCl2�Ĺ�������32.5g������100g����ˮ����ȫ�ܽ����û����Һ����μ�����������Ϊ10%��Na2SO4��Һ����Ӧ����BaSO4�������������������Na2SO4��Һ��������ϵ��ͼ��ʾ���Իش��������⣺����ʾ��BaCl2+Na2SO4�TBaSO4��+2 NaCl��
NaCl��
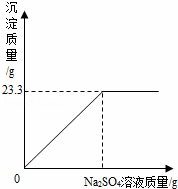
��1����ȫ��Ӧ������BaSO4���� g��
��2��ǡ����ȫ��Ӧʱ����Na2SO4��Һ�������Ƕ��ٿˣ�
��3��ǡ����ȫ��Ӧʱ������Һ�����ʵ����������Ƕ��٣�����ȷ��0.1%��
(1)23.3g.................(2��)
(2)��BaCl2������Ϊx����Ӧ���ɵ�NaCl������Ϊy��ǡ����ȫ��Ӧʱ����Na2SO4������Ϊz
BaCl2+Na2SO4�TBaSO4��+2NaCl
208 142 233 117
x z 23.3g y
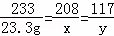 =
=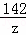
x=20.8g
y=11.7g
z=14.2g....................................(1��)
��2��ǡ����ȫ��Ӧʱ����Na2SO4��Һ������Ϊ��14.2g��10%=142g............��1�֣�
��3��ǡ����ȫ��Ӧʱ����Һ��NaCl������Ϊ��11.7g+��32.5g��20.8g��=23.4g...(1��)
ǡ����ȫ��Ӧʱ����NaCl ��Һ���ʵ���������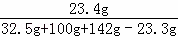 ��100%=9.3%
��100%=9.3%
...............(1��)
��ǡ����ȫ��Ӧʱ����NaCl ��Һ���ʵ���������Ϊ9.3%

С����С��ͬѧ�dz����ڽ���ʵ��̽�������Ƿ��ֳ���ʹ�õ���ˮ���ײ���һ��ˮ����С�������ˮ������Ҫ�ɷ���ʲô��Χ��������⣬����չ����̽��������Ҳ���뵽���ǵ�ѧϰ���̣���Э������������
��������⡿��ˮ���ײ�ˮ������Ҫ�ɷ���ʲô��
���������ϡ�ͨ����������֪������Ȼˮ��ˮ�����������ʼ����ܽ������±���
| ���� | Ca(HCO3)2 | Mg(HCO3)2 | Ca(0H)2 | Mg(0H)2 | CaCO3 | MgCO3 |
| �ܽ��� | ���� | ���� | �� | ���� | ���� | �� |
��������롿ͨ��������������Ϊˮ������Ҫ�ɷ���һ������Mg(0H)2��
��д��ѧʽ����ͬ�������ܺ���Ca(OH)2�� ��
����Ʒ���������ʵ�顿
(1)С�����ձ��з������������ˮ����������������ˮ��ֽ��裬���á�ȡ�ϲ���Һ����Na2CO3��Һ�����û�а�ɫ�������ɣ�˵��ˮ���в�����
(�ѧʽ)��
��2����֤��ˮ���к���̼���ε�ʵ�鷽����
��
(3) Ϊ�˽�һ��ȷ��ˮ���к���̼���εijɷ֣��������������ʵ��װ�á�
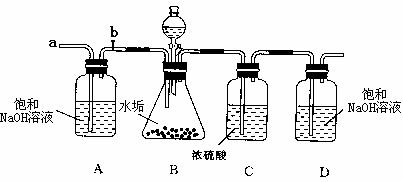
I.С����С�����Ҫʵ�鲽�����£�
�ٰ���ͼ��ʾ��װ��������50gˮ������������ƿ�У���μ�������ϡ���ᡣ
�ڴ���ƿ�в��ٲ�������ʱ������b���ӵ���a����������һ�����Ŀ�����
�۳���Dƿ���������ӵ�������
���ظ��ں͢۵IJ�����ֱ��Dƿ�����ʵ��������䡣
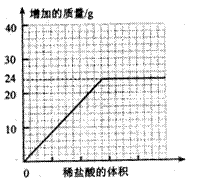 ��������ʵ�飬���Dz����μ�ϡ����������
��������ʵ�飬���Dz����μ�ϡ����������
Dƿ���������������Ĺ�ϵ����ͼ������ʾ��
II. С����С����ȡ50g̼��Ʒ�����ƿ�У���������װ�ã��ظ�I�Т١��ܵIJ���������Dƿ���������ӵ�������22g.
��ʵ�����ۡ�
(1)Aƿ�е�NaOH��Һ�� ���á���Aƿ����NaOH��Һ��Dƿ�е������� (����������䡱��С��)��Dƿ�з�����Ӧ�Ļ�ѧ����ʽΪ ��Cƿ��Ũ����������� ��
��2����ʵ��I��II�У�С����С�������˻�ѧʵ���е� ������
(3)һ������£����ֲ�ͬ�����γɵ�̼�������������ᷴӦʱ �������ֽ����Ļ��ϼ���ͬ�������ε�������ͬ������Է�������С�߷ų�������ࡣ����ʵ��I��II��֪��ˮ����һ������
�������ֽ����Ļ��ϼ���ͬ�������ε�������ͬ������Է�������С�߷ų�������ࡣ����ʵ��I��II��֪��ˮ����һ������  (�ѧʽ)��������
(�ѧʽ)��������
��
��4������ʵ�� (��ܹ������ܡ�) ����ˮ�����Ƿ���Mg(OH)2
H2S�ж�����������ã���H2S��β��Ҫ�����ر������Է�ֹ������Ⱦ������װ�ô���H2Sβ����Ч����õ��� �� ��
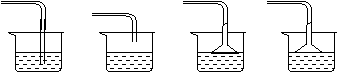 |
����������Һ ����������Һ ����������Һ ˮ
A B C D

 ��������ˮ����ʯ���� ;
��������ˮ����ʯ���� ; �ټ�ͬѧ���Һ�м����̪���۲쵽��̪��죬������Ϊ������������ơ�
�ټ�ͬѧ���Һ�м����̪���۲쵽��̪��죬������Ϊ������������ơ� �� ��
�� �� ���������ũҩ������
���������ũҩ������ A���������������ʣ�A��B
A���������������ʣ�A��B �����ԼΪ ��cΪ��Դ�� �����������������
�����ԼΪ ��cΪ��Դ�� �����������������