题目内容
取一定质量的石灰石(所含杂质不溶于水,不与酸反应,高温也不分解),高温煅烧一段时间后得到78g固体,该固体与400g浓度为14.6%的稀盐酸恰好完全反应后,过滤得到20g滤渣,则原石灰石中碳酸钙的质量分数为
80%
80%
.分析:石灰石高温锻烧,碳酸钙分解生成氧化钙和二氧化碳,锻烧后固体与盐酸反应,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳而氧化钙与盐酸生成氯化钙和水,因此,反应后所得溶液一定是氯化钙,其中钙元素质量即石灰石中碳酸钙中钙元素的质量、氯元素质量即所加盐酸中氯元素质量;利用氯化钙中氯元素与钙元素质量关系,可由盐酸中所含氯元素质量求得碳酸钙中钙元素质量,进而计算出碳酸钙的质量,最终根据题意完成原石灰石样品中碳酸钙的质量分数的计算.
解答:解:400g质量分数为14.6%的稀盐酸中所含氯元素质量=400g×14.6%×
×100%=56.8g
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=
×40=32g
石灰石中碳酸钙的质量=
×100%=80g,依据题意可知过滤所得的滤渣即为原石灰石中的杂质;
则原石灰石样品中碳酸钙的质量分数=
×100%=80%
故答案为:80%
| 35.5 |
| 36.5 |
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=
| 56.8g |
| 71 |
石灰石中碳酸钙的质量=
| 32g | ||
|
则原石灰石样品中碳酸钙的质量分数=
| 80g |
| 80g+20g |
故答案为:80%
点评:根据化学变化前后元素质量不变,通过氯化钙中氯元素与钙元素质量关系,建立盐酸与碳酸钙的质量关系,这是解答本题的技巧所在.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
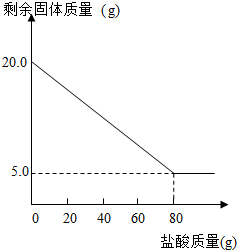
请细心观查表格和图象,回答下列问题:
(1)涉及反应的化学方程式为 ;
(2)第 次石灰石中的碳酸钙与盐酸恰好反应完毕;
(3)该石灰石样品中碳酸钙的质量分数为 ;
(4)表格中m= g;
(5)该样品完全反应生成二氧化碳的质量是 g.
| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| ① | 20 | 16.25 |
| ② | 40 | 12.50 |
| ③ | 60 | M |
| ④ | 80 | 5.00 |
| ⑤ | 100 | 5.00 |

请细心观查表格和图象,回答下列问题:
(1)涉及反应的化学方程式为
(2)第
(3)该石灰石样品中碳酸钙的质量分数为
(4)表格中m=
(5)该样品完全反应生成二氧化碳的质量是
 某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下: