题目内容
晴晴同学为探究某石灰石样品中碳酸钙的质量分数(杂质不与酸反应),向6.0g石灰石样品中逐滴加入稀盐酸至不再产生气泡为止,共生成二氧化碳气体1.11L(该条件下二氧化碳气体的密度约为1.977g/L).试计算:
(1)该反应生成二氧化碳的质量为________g;(精确至0.1g)
(2)该石灰石样品中碳酸钙的质量分数为多少?(写出计算过程,结果精确到0.1%)
(3)若要计算上述反应中所消耗盐酸的质量,题中还缺少的一个数据是________.
解:(1)反应生成二氧化碳的质量为:1.11L×1.977g/L≈2.2g.
故答案为:2.2g.
(2)设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
∴100:44=x:2.2g
解之得:x=5g,
该石灰石样品中碳酸钙的质量分数为: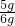 ×100%≈83.3%.
×100%≈83.3%.
答:该石灰石样品中碳酸钙的质量分数为83.3%.
(3)根据化学方程式可以计算出参与反应的HCl的质量,若要计算上述反应中所消耗盐酸的质量,还须有稀盐酸中溶质的质量分数.故答案为:稀盐酸中溶质的质量分数.
分析:(1)根据物理公式质量=密度×体积计算即可;
(2)根据碳酸钙和盐酸反应的化学方程式,得出各物质之间的质量比,列出比例式,即可计算出石灰石样品中碳酸钙的质量,然后根据质量分数公式计算即可;
(3)根据化学方程式可以计算出参与反应的HCl的质量,若要计算上述反应中所消耗盐酸的质量,还须有稀盐酸中溶质的质量分数.
点评:本题主要考查学生运用化学方程式进行计算的能力.
故答案为:2.2g.
(2)设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
∴100:44=x:2.2g
解之得:x=5g,
该石灰石样品中碳酸钙的质量分数为:
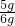 ×100%≈83.3%.
×100%≈83.3%.答:该石灰石样品中碳酸钙的质量分数为83.3%.
(3)根据化学方程式可以计算出参与反应的HCl的质量,若要计算上述反应中所消耗盐酸的质量,还须有稀盐酸中溶质的质量分数.故答案为:稀盐酸中溶质的质量分数.
分析:(1)根据物理公式质量=密度×体积计算即可;
(2)根据碳酸钙和盐酸反应的化学方程式,得出各物质之间的质量比,列出比例式,即可计算出石灰石样品中碳酸钙的质量,然后根据质量分数公式计算即可;
(3)根据化学方程式可以计算出参与反应的HCl的质量,若要计算上述反应中所消耗盐酸的质量,还须有稀盐酸中溶质的质量分数.
点评:本题主要考查学生运用化学方程式进行计算的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来.如如图是过滤操作示意图,请指出错误,并加以改正.
过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来.如如图是过滤操作示意图,请指出错误,并加以改正.
| 错误之处 | 改正方法 |
| ________ | ________ |
| ________ | ________ |
| ________ | ________ |
 用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应.产生氢气的质量和反应所用时间的关系如图所示.则下列说法不正确的是
用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应.产生氢气的质量和反应所用时间的关系如图所示.则下列说法不正确的是

 .
.
 小芳从废干电池中回收有关物质并进行探究.
小芳从废干电池中回收有关物质并进行探究.