题目内容
14.今有KClO3和MnO2的混合物30g,将它加热使之完全分解,在该温度时,将残留固体加入15克水中,有11.4克固体未溶解,在相同温度下,再加入7.5克水,仍有7.5克固体未溶解,该固体仍有KCl,试求:(1)原混合物完全分解后所得固体总质量
(2)原混合物中KClO3的质量分数.
分析 根据氯酸钾和二氧化锰混合生成氯化钾和氧气,其中二氧化锰难溶于水,而氯化钾易溶于水,未溶的7.5克固体为MnO2与KCl的混合物说明两次溶液是饱和的,溶液中溶质与溶剂的比例相同进行分析解答.
解答 解:未溶的7.5克固体为MnO2与KCl的混合物,则7.5克水溶解的质量为:11.4克-7.5克=3.9克,t℃时15克水溶解的KCl质量为:3.9克×2=7.8克,反应后剩余固体的总质量为:11.4克+7.8克=19.2克.则生成氧气的质量=30g-19.2g=10.8g
设原混合物中含KClO3质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 10.8g
$\frac{245}{x}$=$\frac{96}{10.8g}$
x=27.56g
原混合物中氯酸钾的质量分数=$\frac{27.56g}{30g}$×100%=91.9%
答:原混合物中氯酸钾的质量分数为91.9%
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氧气的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
4.运用化学知识可以解决许多实际问题.下表中完全正确的一组是( )
| A | 安全常识 | B | 区分常见物质 |
| 天然气泄漏--立即打开换气扇 海鲜防腐--甲醛溶液浸泡 预防煤气中毒--确保烟道畅通 | 硬水和软水--加肥皂水 涤纶和羊毛纤维--点燃并闻气味 食盐和纯碱--观察颜色 | ||
| C | 物质的性质与用途 | D | 化学元素与人体健康 |
| N2性质稳定--作保护气 活性炭具有吸附性--除异味 钨的熔点高--做灯丝 | 缺碘--会患甲状腺肿大 缺钙--易患骨质疏松或佝偻病 缺维生素C--会引起夜盲症 |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质的用途中,主要利用其化学性质的是( )
| A. | 氦气填充气球 | B. | 石墨作电极 | C. | 水银填充温度计 | D. | 氧气用于制炸药 |
6.属于纯净物的是( )
| A. | 煤 | B. | 石油 | C. | 石灰水 | D. | 干冰 |
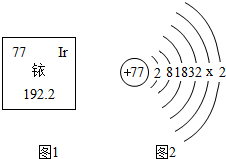 3•15晚会曝光,在一些商场黄金专柜出售的千足金,含量并不达标.原因之一是首饰加工行业将黄金中加入相对价格较低的金属铱.如图是铱在元素周期表中的信息及原子结构示意图.
3•15晚会曝光,在一些商场黄金专柜出售的千足金,含量并不达标.原因之一是首饰加工行业将黄金中加入相对价格较低的金属铱.如图是铱在元素周期表中的信息及原子结构示意图.