题目内容
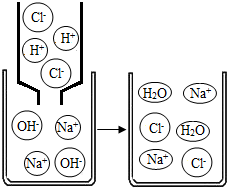
某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:

【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是 溶液。
(2)小刚另取样滴加稀盐酸有 产生,小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由是在空气中变质的氢氧化钠与盐酸反应也能产生气泡。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是 。
【探究启示】实验取完药品后应 。
(1)氯化钠 (2)气泡(气体)
白色沉淀 除去溶液中的碳酸钠
部分变质的氢氧化钠溶液
密封保存(盖好试剂瓶盖)
【解析】
试题分析:【实验推断】
(1)由于氢氧化钠和碳酸钠的溶液都呈碱性,故都能使酚酞试液变红色;而氯化钠溶液呈中性,不能使酚酞试液变色,所以通过小丽的实验可知,该溶液不可能是氯化钠溶液。
(2)根据小刚的操作“另取样滴加稀盐酸”,以及其结论“该溶液是碳酸钠溶液”可知,滴加稀盐酸后有气泡产生,因为碳酸钠能与盐酸反应,生成氯化钠、水和二氧化碳。
【继续探究】根据上面的分析可知,溶液中含有碳酸钠,故另取样加入过量的CaCl2溶液后,二者反应生成碳酸钙沉淀和氯化钠,故可观察到溶液变浑浊(或有白色沉淀生成),而加过量的氯化钙溶液,是为了除尽碳酸钠,因为碳酸钠溶液也呈碱性,会干扰到用酚酞检验氢氧化钠的存在。
【实验结论】由于碳酸钠已完全除去,而此时取上层清液,滴加酚酞后溶液仍变红色,说明仍有氢氧根的存在,即这瓶溶液是NaOH溶液,但已变质(生成碳酸钠)。
【探究启示】由于氢氧化钠易与空气中的二氧化碳反应,所以,实验取完药品后应立即盖好瓶盖,密封保存。
考点:缺失标签的药品成分的探究,证明碳酸盐(CO32-检验方法),酸碱指示剂及其性质,碱的化学性质,盐的化学性质
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 名校课堂系列答案
名校课堂系列答案 某校兴趣小组同学准备进行常见的酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一个装溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对这瓶溶液进行实验探究:
某校兴趣小组同学准备进行常见的酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一个装溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对这瓶溶液进行实验探究: