题目内容
(5分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将x g KClO3与1.0 g MnO2均匀混合加热
Ⅱ.将3.0 g KClO3与1.0 g CuO均匀混合加热在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中x的值应为________;Ⅱ中反应的化学方程式是________。
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
|
|
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2的体积 |
|
Ⅰ |
50.0 g |
1% |
0.1 g |
9 mL |
|
Ⅱ |
50.0 g |
2% |
0.1 g |
16 mL |
|
Ⅲ |
50.0 g |
4% |
0.1 g |
31 mL |
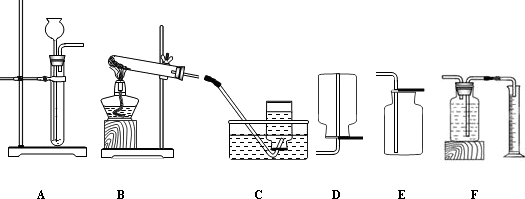
本实验中,测量O2的体积可选用下图中的______(填字母序号)。
A B C D
实验结论:在相同条件下,___________。丙用右图装置进行实验,通过比较__________也能达到实验目的。

(1)3.0 2KClO3  2KCl
+ 3O2↑
2KCl
+ 3O2↑
(2)CD 在相同条件下,双氧水的浓度越大,产生氧气的速率越快(或双氧水分解的速率越快)。 通过比较相同时间内,电子天平示数的变化大小。
【解析】
试题分析:(1) 在做对比实验时要求有且只有一个变量不同,也就是两组实验只有一个条件不同,其他条件都要相同,这才能够判断这个不同的条件是不是影响因素。Ⅰ和Ⅱ两个实验中的不同点是选择了不同的催化剂,因此其他的条件应相同。所以x的值应为3.0克。实验Ⅱ用氧化铜作催化剂,所以化学方程式为2KClO3  2KCl
+ 3O2↑
2KCl
+ 3O2↑
(2)本实验装置必须保证排出水的导管应接近集气瓶的底部,故选CD装置,由实验数据可知在相同条件下,双氧水的浓度越大,产生氧气的速率越快。通过丙的装置图可知其意图是通过比较单位时间内或者相同时间内电子天平示数的变化大小达到实验目的。
考点:实验室制备氧气条件的探究实验。
点评:本题通过变换条件探究影响实验室制备氧气速率的因素,关键是要认清在做对比实验时要求有且只有一个变量不同,也就是两组实验只有一个条件不同,其他条件都要相同,这才能够判断这个不同的条件是不是影响因素。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案

 某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.
某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.

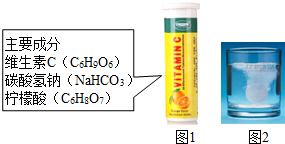 维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.
维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.