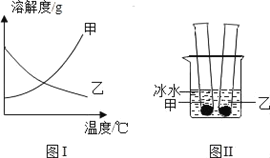
题目内容
【题目】小亮同学想通过实验探究某企业采用的氨碱法制的纯碱样品的成分及含量。
[提出问题1]①该纯碱样品中含有哪些物质?
[猜想与假设]通过分析,小亮做出如下假设:
(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3
[查阅资料]
NaHCO3 | Na2CO3 | |
加入稀盐酸 | 现象I | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象Ⅱ为___________;
(2)现象I对应的化学方程式为_________。
[实验探究]为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告。
实验步骤 | 实验现象 | |
①取少量样品溶于水,加入过量的CaCl2溶液 | 溶液变浑浊 | 该反应的化学方程式:___________; |
②将上述反应后的混合液过滤,取滤液_______; | _______; | 证明猜想②成立。 |
[实验反思]
实验步骤①中,加入试剂过量的目的是_______;
[提出问题2]如何测量该纯碱样品中各物质的含量?

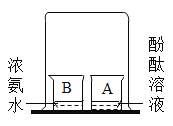
(1)为测量该纯碱样品各成分的含量,小亮设计了如图装置,通过称量B装置中的质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有
①__________;②__________;
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:

①检查装置气密性;②将w g干燥的样品放入锥形瓶中;
③称量盛有氢氧化钠浓溶液的B瓶质量;
④打开活塞b,从导管a处缓缓注入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量计算样品中各成分的含量。
该实验的正确步骤是___________;
【答案】产生白色沉淀 NaHCO3+HCl=NaCl+H2O+CO2↑ Na2CO3+CaCl2=CaCO3↓+2NaCl 稀盐酸 有气泡冒出 除尽样品中的碳酸钠,避免对步骤②中碳酸氢钠的检验造成干扰 空气中的二氧化碳进入装置B中被氢氧化钠吸收 装置A中残留的二氧化碳未被装置B中的氢氧化钠吸收 ①③②④⑥⑤⑦
【解析】
(1)饱和石灰水是氢氧化钙溶液,与碳酸钠溶液反应生成碳酸钙白色沉淀和氢氧化钠,故表中的现象Ⅱ为产生白色沉淀;
(2)稀盐酸与NaHCO3溶液反应生成氯化钠、水、二氧化碳,反应的化学方程式为: NaHCO3+HCl=NaCl+H2O+CO2↑
[实验探究]①碳酸钠溶液与氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;②该步骤是证明存在碳酸氢钠,第一步将碳酸钠完全除尽,故将上述反应后的混合液过滤,取滤液加入稀盐酸,如果有气泡产生,说明存在碳酸氢钠,故对应的实验现象是有气泡冒出。
[实验反思]
实验步骤①中,加入试剂过量的目的是除尽样品中的碳酸钠,避免对步骤②中碳酸氢钠的检验造成干扰;
[提出问题2]
(1)造成偏差的原因有:①空气中的二氧化碳进入装置B中被氢氧化钠吸收;②装置A中残留的二氧化碳未被装置B中的氢氧化钠吸收;
(2)在进行实验前需检验装置的气密性,故①为第一步;③可排除装置中原有二氧化碳对实验的影响,故③为第二步;进行实验前应称量B瓶质量,以便与反应结束后的B瓶质量比较并计算,故②为第三步;然后进行实验,故④为第三步;实验结束后需鼓入空气以排尽装置中残留的二氧化碳,故⑥为第五步;待二氧化碳吸收完全后,再称量B瓶质量,故⑤为第六步;最后计算两次称量B瓶的质量差,从而计算样品中各成分的质量,故⑦为第七步。故填:①③②④⑥⑤⑦。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D