题目内容
实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组发现一瓶未密闭的NaOH固体,对其成分提出以下假设,并完成了实验探究.
假设1:只含NaOH; 假设2:含NaOH和Na2CO3; 假设3:只含Na2CO3
(1)取少量样品于试管中,加入足量稀盐酸,观察到 ,说明假设1不成立,假设2或假设3成立.
(2)进一步探究的过程如下:
①“操作1”的名称是 ,其中要用到玻璃棒,其作用是 .
②加入足量CaCl2溶液的作用是 .
③加酚酞检验“溶液B”的现象是 .

假设1:只含NaOH; 假设2:含NaOH和Na2CO3; 假设3:只含Na2CO3
(1)取少量样品于试管中,加入足量稀盐酸,观察到
(2)进一步探究的过程如下:
①“操作1”的名称是
②加入足量CaCl2溶液的作用是
③加酚酞检验“溶液B”的现象是
考点:药品是否变质的探究,过滤的原理、方法及其应用,碱的化学性质,盐的化学性质
专题:科学探究
分析:(1)根据碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳分析现象;
(2)①过滤可以把不溶于水的物质除去,其中玻璃棒起到引流的作用;
②氢氧化钠、碳酸钠的水溶液都显碱性,都能够使酚酞试液变红色,因此要想检验氢氧化钠部分变质,应先除去碳酸钠再证明溶液显碱性,才能说明部分变质;
③根据B的成分分析对酚酞的作用.
(2)①过滤可以把不溶于水的物质除去,其中玻璃棒起到引流的作用;
②氢氧化钠、碳酸钠的水溶液都显碱性,都能够使酚酞试液变红色,因此要想检验氢氧化钠部分变质,应先除去碳酸钠再证明溶液显碱性,才能说明部分变质;
③根据B的成分分析对酚酞的作用.
解答:解:(1)氢氧化钠和二氧化碳发生反应生成碳酸钠和水,取少量样品于试管中,加入足量稀盐酸,如果观察到有气泡产生,说明样品中含有碳酸钠,说明假设2或假设3成立;
(2)①操作1的名称是过滤,可以把反应生成的碳酸钙分离出来,其中玻璃棒起到引流作用;
②为了排除碳酸钠对实验结果的影响,应该加入足量CaCl2溶液把碳酸钠除去,如果向溶液B中滴加酚酞试液时,酚酞试液变红色,说明样品中含有氢氧化钠;
③溶液B中含有氢氧化钠,因此能够使酚酞试液变成红色;
故答案为:(1)有气泡产生;(2)①过滤;引流; ②将碳酸钠完全反应(除掉溶液中的碳酸钠),防止对氢氧化钠检验的干扰;③溶液变成红色.
(2)①操作1的名称是过滤,可以把反应生成的碳酸钙分离出来,其中玻璃棒起到引流作用;
②为了排除碳酸钠对实验结果的影响,应该加入足量CaCl2溶液把碳酸钠除去,如果向溶液B中滴加酚酞试液时,酚酞试液变红色,说明样品中含有氢氧化钠;
③溶液B中含有氢氧化钠,因此能够使酚酞试液变成红色;
故答案为:(1)有气泡产生;(2)①过滤;引流; ②将碳酸钠完全反应(除掉溶液中的碳酸钠),防止对氢氧化钠检验的干扰;③溶液变成红色.
点评:此题考查对一瓶没有密闭保存的氢氧化钠固体进行实验探究过程,在证明氢氧化钠部分变质时,先除去氢氧化钠中的碳酸钠,然后再证明剩余溶液显碱性,才能说明氢氧化钠部分变质.

练习册系列答案
相关题目
金属镍及其氧化物能发生如下反应:①Ni+2HCl═NiCl2+H2↑ ②NiO+2HCl═NiCl2+H2O
分析化学方程式可知,下列说法错误的是( )
分析化学方程式可知,下列说法错误的是( )
| A、反应①属于置换反应 |
| B、镍能与硝酸银溶液反应 |
| C、反应②中镍的化合价没有改变 |
| D、等质量的Ni和NiO分别与等质量足量的稀盐酸充分反应后,所得NiCl2溶液质量相等 |
生活中的下列物品,用合成材料制作的是( )
| A、塑料洗衣盆 |
| B、纯羊毛衣服 |
| C、铝合金门窗 |
| D、景德镇瓷器 |
 如图是医用输液观察滴夜快慢的滴壶,若把它作为微型洗气装置,则气体应从
如图是医用输液观察滴夜快慢的滴壶,若把它作为微型洗气装置,则气体应从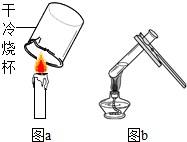 (1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是
(1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是
