题目内容
8.实验室里有一包部分变质的熟石灰,小明同学想验证它的变质情况.他取14.8g该样品,放入烧杯中,加入足量稀盐酸充分反应后,他又向烧杯中加入足量的碳酸钠溶液,完全反应后过滤,干燥后得滤渣17.4g,则该部分变质的熟石灰样品中未变质的熟石灰所占的质量分数为( )| A. | 25% | B. | 42% | C. | 50% | D. | 84% |
分析 该题中所发生的反应为碳酸钠和熟石灰的反应,反应生成了碳酸钙沉淀,可以利用差量法来解答该题.
解答 解:设样品中未变质的熟石灰的质量为x
Na2CO3+Ca(0H)2═CaCO3↓+2NaOH 固体质量差
74 100 100-74=26
x 17.4g-14.8g=2.6g
$\frac{74}{x}=\frac{26}{2.6g}$
x=7.4g
则该部分变质的熟石灰样品中未变质的熟石灰所占的质量分数为:$\frac{7.4g}{14.8g}×$100%=50%
答案:C
点评 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后根据所给的问题情景细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
18.下列生活方式中,不符合“践行绿色生活”理念的是( )
| A. | 用手帕代替纸巾 | B. | 将废弃的干电池扔入河道 | ||
| C. | 短途旅游时用自行车代替机动车 | D. | 垃圾分类后放入指定的垃圾箱 |
17.科学家采用“组合转化”技术,可将二化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )


| A. | 参加反应的两种分子的个数比是1:4 | |
| B. | 无机物在一定条件下可转化为有机物 | |
| C. | 反应前后原子种类、数目均不变 | |
| D. | 乙烯的化学式为C2H4 |
18. 目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是( )
目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是( )
 目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是( )
目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是( )| A. | 酒精的燃烧是为了升高温度 | |
| B. | 炭灰可以隔绝空气而使机制炭熄灭 | |
| C. | 酒精的燃烧会升高机制炭的着火点 | |
| D. | 机制炭做成空心可以增大与空气的接触面积 |



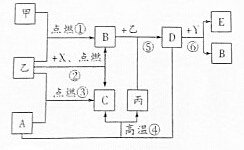 如图所示是初中化学中常见物质间的转化关系(部分生成物已略去),其中甲、乙为气态单质,丙是目前应用最广泛的金属,A、B、C、D均为氧化物,常温下B为液态,化合物E的水溶液呈黄色.
如图所示是初中化学中常见物质间的转化关系(部分生成物已略去),其中甲、乙为气态单质,丙是目前应用最广泛的金属,A、B、C、D均为氧化物,常温下B为液态,化合物E的水溶液呈黄色. 图中的五个圆A、B、C、D、E分别表示碳酸钾溶液,稀硫酸,氢氧化钡溶液,氧化铜和二氧化碳五种物质中的一种.用“→”表示一种物质能转化为另一种物质,用两圆相切表示两种物质可以发生化学反应.请回答下列问题:
图中的五个圆A、B、C、D、E分别表示碳酸钾溶液,稀硫酸,氢氧化钡溶液,氧化铜和二氧化碳五种物质中的一种.用“→”表示一种物质能转化为另一种物质,用两圆相切表示两种物质可以发生化学反应.请回答下列问题: