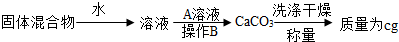题目内容
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.I、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是.
甲:适量稀盐酸 乙:过量KOH溶液
丙:适量Ba(OH)2溶液 丁:适量CaCl2溶液.
II、第二组选用另一种方案测定NaOH和Na2CO3的混合物(质量为a g)中Na2CO3的质量分数,其操作流程如下:

(1)如果A是两种元素组成的盐,则A是(填化学式).
(2)B操作的名称是.
该实验要求加入的A溶液必须过量,检查原溶液中Na2CO3已经反应完的方法是.
(3)混合物中Na2CO3的质量分数为(用a、c的代数式表示)
【答案】分析:I、可以根据物质的性质方面进行分析、判断,从而得出I的正确的结论.如除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡可氢氧化钙微溶,所以选氢氧化钡,所以选丙;
II、分析实验数据和实验过程根据质量分数的求解方法得出,先求碳酸钠的质量再求质量分数即可得第II的答案.
解答:解:I、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去;
甲、盐酸,盐酸即与碳酸钠反应也和氢氧化钠反应,故甲方案不行;
乙、氢氧化钾和碳酸钠不反应;
丙、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡,可氢氧化钙微溶,所以选氢氧化钡,所以选丙;
丁、氯化钙和碳酸钠生成碳酸钙沉淀,同时若氯化钙过量也会和氢氧化钠反应生成少量的氢氧化钙和碳酸钠,还有杂质,故丁方案不行;
II、(1)过第二步操作得到碳酸钙沉淀,故加入的A溶液能与碳酸钠反应生成碳酸钙沉淀,A是两种元素组成的盐,则A是CaCl2;
(2)B操作是过滤,检查原溶液中Na2CO3已反应完,就看上层清液中是否含有Na2CO3,加入盐酸检验,取上层清液加入盐酸,无气泡产生,则Na2CO3已反应完;
(3)根据生成碳酸钙的质量,计算碳酸钠的质量,进而求出混合物中碳酸钠的质量分数;
设xg碳酸钠和氯化钙反应生成cg碳酸钙,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
xg cg
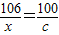
x=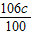
混合物中碳酸钠的质量分数: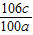 ×100%=
×100%=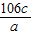 %.
%.
故答案为:
I、丙;
II、(1)CaCl2;
(2)过滤,取上层清液加入盐酸,无气泡产生,则Na2CO3已反应完;
(3)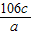 %.
%.
点评:解答本题的关键是要充分理解各种物质的性质,只有这样才能对问题做出正确的判断.
II、分析实验数据和实验过程根据质量分数的求解方法得出,先求碳酸钠的质量再求质量分数即可得第II的答案.
解答:解:I、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去;
甲、盐酸,盐酸即与碳酸钠反应也和氢氧化钠反应,故甲方案不行;
乙、氢氧化钾和碳酸钠不反应;
丙、除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡,可氢氧化钙微溶,所以选氢氧化钡,所以选丙;
丁、氯化钙和碳酸钠生成碳酸钙沉淀,同时若氯化钙过量也会和氢氧化钠反应生成少量的氢氧化钙和碳酸钠,还有杂质,故丁方案不行;
II、(1)过第二步操作得到碳酸钙沉淀,故加入的A溶液能与碳酸钠反应生成碳酸钙沉淀,A是两种元素组成的盐,则A是CaCl2;
(2)B操作是过滤,检查原溶液中Na2CO3已反应完,就看上层清液中是否含有Na2CO3,加入盐酸检验,取上层清液加入盐酸,无气泡产生,则Na2CO3已反应完;
(3)根据生成碳酸钙的质量,计算碳酸钠的质量,进而求出混合物中碳酸钠的质量分数;
设xg碳酸钠和氯化钙反应生成cg碳酸钙,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
xg cg
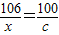
x=
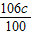
混合物中碳酸钠的质量分数:
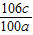 ×100%=
×100%=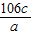 %.
%.故答案为:
I、丙;
II、(1)CaCl2;
(2)过滤,取上层清液加入盐酸,无气泡产生,则Na2CO3已反应完;
(3)
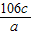 %.
%.点评:解答本题的关键是要充分理解各种物质的性质,只有这样才能对问题做出正确的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验测知久储的某NaOH固体中含有水的质量分数为3.5%,含Na2CO3的质量分数为6.5%.若取质量为ag的此样品加入到含HCl质量为bg的稀盐酸(过量)中,完全反应后加入含NaOH质量为cg的NaOH溶液,恰好中和残余的盐酸,则所得溶液蒸干时得到晶体质量可能为( )
| A、1.3ag | B、1.6bg | C、1.32ag+1.46cg | D、1.39ag+1.46cg |
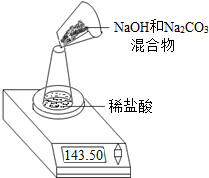 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ,第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸 乙:过量KOH溶液 丙:适量Ba(OH)2溶液 丁:适量CaCl2溶液.
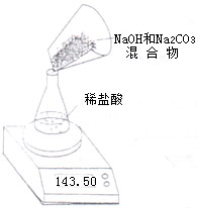
Ⅱ,第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:则混合物中Na2CO3的质量分数为
| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 148.30 |

(1)A是
(2)B操作的名称是
(3)混合物中Na2CO3的质量分数为
 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第三次称量的质量 | 148.30 |
(2)混合物中Na2CO3的质量分数为
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物
| 水 |
| ||
| 操作B |
| ||
| 称量 |
(1)A是
(2)B操作的名称是
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)