题目内容
实验课上,同学们用下图所示四种溶液探究与指示剂的作用.实验后进行废液处理,处理过程为:将A和B中液体混合,得到红色溶液E;将C和D中液体混合,得到废液F;将E和F放入烧杯中.
(1)向A中滴加无色酚酞溶液后,溶液颜色为______色.
(2)A和B混合后,溶液中一定没有______.
a.NaCl b.HCl c.NaOH
(3)C和D混合时发生反应的化学方程式为______.
(4)继续对烧杯中的废液成分进行如下探究.
【提出问题】烧杯废液中含有什么物质?
【查阅资料】碳酸钠溶液呈碱性;CaCl2 溶液呈中性.
【初步分析】通过分析上述实验现象,烧杯中的废液除酚酞和水外还一定含有______.
【进行实验】请设计实验验证可能含有的物质
| 实验操作 | 现象与结论 |
【答案】分析:(1)酸性溶液不能使酚酞变色;
(2)将A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定没有盐酸;
(3)根据碳酸钠和氢氧化钙反应原理书写方程式;
(4)根据盐酸和氢氧化钠、碳酸钠和氢氧化钙反应原理及实验现象分析烧杯中废液的成分;并据物质的性质设计实验进行验证;
(5)依据题意:要使溶液呈中性,可依据酸和碱可反应的性质设计实验.
解答:解:(1)稀盐酸不能使酚酞变色;
(2)将A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定没有盐酸;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)由A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定含有氢氧化钠和反应生成的氯化钠;碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,则废液中一定含有碳酸钙、氢氧化钠、氯化钠;
由于碳酸钠和氢氧化钙是否完全反应无法判断,故废液中可能含有碳酸钠或氢氧化钙;
根据碳酸钠可与盐酸反应生成二氧化碳,可将废液过滤,然后取滤液滴加稀盐酸,若有气泡产生,说明含有碳酸钠;另外取滤液滴加碳酸钠溶液,若有沉淀产生,则含氢氧化钙,若两支试管中均无现象,则不含两种物质;
(5)由于废液中含有氢氧化钠,所以要实现绿色排放,可向废液中滴加稀盐酸,至溶液中红色恰好消失;
故答案为:(1)无;
(2)b;
(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)CaCO3、NaOH、NaCl;
(5)滴加盐酸至中性(或滴加盐酸至红色消失).
点评:掌握物质的性质、指示剂的变色情况等知识,并能据物质的性质设计实验是解答此题的基础和关键.
(2)将A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定没有盐酸;
(3)根据碳酸钠和氢氧化钙反应原理书写方程式;
(4)根据盐酸和氢氧化钠、碳酸钠和氢氧化钙反应原理及实验现象分析烧杯中废液的成分;并据物质的性质设计实验进行验证;
(5)依据题意:要使溶液呈中性,可依据酸和碱可反应的性质设计实验.
解答:解:(1)稀盐酸不能使酚酞变色;
(2)将A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定没有盐酸;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)由A和B中液体混合,得到红色溶液E,说明溶液显碱性,则一定含有氢氧化钠和反应生成的氯化钠;碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,则废液中一定含有碳酸钙、氢氧化钠、氯化钠;
由于碳酸钠和氢氧化钙是否完全反应无法判断,故废液中可能含有碳酸钠或氢氧化钙;
根据碳酸钠可与盐酸反应生成二氧化碳,可将废液过滤,然后取滤液滴加稀盐酸,若有气泡产生,说明含有碳酸钠;另外取滤液滴加碳酸钠溶液,若有沉淀产生,则含氢氧化钙,若两支试管中均无现象,则不含两种物质;
(5)由于废液中含有氢氧化钠,所以要实现绿色排放,可向废液中滴加稀盐酸,至溶液中红色恰好消失;
故答案为:(1)无;
(2)b;
(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)CaCO3、NaOH、NaCl;
| 实验操作 | 现象与结论 |
| ①将废液过滤 ②取少量滤液于试管中,向其中滴加稀盐酸 ③取少量滤液于试管中,向其中加入碳酸钠溶液 | 若有气泡产生,则含碳酸钠 若有沉淀产生,则含氢氧化钙 若两支试管均无现象,两种物质均没有 |
点评:掌握物质的性质、指示剂的变色情况等知识,并能据物质的性质设计实验是解答此题的基础和关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
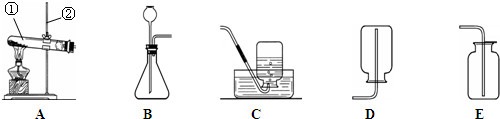
实验课上,同学们利用如图所示装置进行气体制备.

(1)写出图中有标号的仪器的名称:① 、② .
(2)反应原理:实验室用加热高锰酸钾制取氧气的化学方程式为 .用大理石和稀盐酸制取二氧化碳的化学方程式为 .
(3)气体制备:二氧化碳的发生装置是 A
(填序号,下同).
(4)气体的收集:实验室收集氧气的装置可选用 ,选择该收集方法是根据氧气具有 的性质.
(5)气体的检验:
(6)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室可用加热氯化铵和氢氧化钙固体混合物制得氨气.氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.制取氨气应选择 和 装置连接.请写出氨气和氧化铜(CuO)反应的化学方程式 .

(1)写出图中有标号的仪器的名称:①
(2)反应原理:实验室用加热高锰酸钾制取氧气的化学方程式为
(3)气体制备:二氧化碳的发生装置是 A
(填序号,下同).
(4)气体的收集:实验室收集氧气的装置可选用
(5)气体的检验:
| 气体 | 检验方法 | 实验现象 |
| O2 | ||
| CO2 |