题目内容
9.汽车尾气中的主要污染物有一氧化碳、氮的氧化物、含铅化合物和烟尘等.某种催化剂可将尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分.请根据该反应的微观示意图,分析下列说法正确的是( )
| A. | 四种物质均属于氧化物 | B. | 丙物质中碳、氧元素的质量比为3:8 | ||
| C. | 甲和乙的分子个数比为1:1 | D. | 丁分子的微观示意图为 |
分析 由反应的微观示意图可知:反应前后元素的种类不变;反应物和生成物的物质分类;其各物质的分子构成等信息.
解答 解:根据题意和质量守恒定律可知,一氧化碳、二氧化氮在催化剂的作用下应生成了二氧化碳和氮气,反应的化学方程式是:2NO2+4CO $\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2.
A、由方程式可知,生成物中的丁是氮气,属于单质,故A说法错误;
B、丙物质是二氧化碳,碳、氧元素的质量比为3:8,故B说法正确;
C、由化学方程式可知甲和乙的分子个数比1:2,故C说法错误;
D、丁为氮气是单质,该选项给出的微观示意图中有两种元素是化合物,故D说法错误.
故选B.
点评 模型能直观地表示了变化的微观过程;试题通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力.

练习册系列答案
相关题目
20.下列各组元素都是金属元素的一组是( )
| A. | Cu S Mg | B. | Ca Na Fe | C. | H Al P | D. | K Zn O |
1.下列实验操作正确的是( )
| A. |  取用固体药品 | B. |  点燃酒精灯 | C. |  闻气体气味 | D. |  倾倒液体 |
18.下列关于实验现象的描述中,正确的是( )
| A. | 红磷在空气中燃烧,产生大量的白雾 | |
| B. | 木炭在氧气中燃烧,发出白光,生成二氧化碳 | |
| C. | 铁丝在空气中燃烧,火星四射,生成黑色固体 | |
| D. | 氢气在空气中燃烧,产生淡蓝色火焰,放出大量的热,烧杯内壁有水雾 |
5.下列化学用语书写错误的是( )
| A. | 2个钠离子-2$\stackrel{+1}{Na}$ | B. | 2个氢分子-2H2 | ||
| C. | 2个氧原子-2O | D. | 碳原子结构示意图-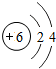 |


