题目内容
A、B、C、D四种非金属元素,A.B反应中各结合一个电子形成稳定结构,放出能量B<A,氢化物稳定性HD>HA,原子序数C<B,其稳定结构的核外电子数相等,则四种元素非金属性由强到弱的顺序正确的是( )
分析:A、B两元素的原子分别获得一个电子形成稳定结构时,A放出的能量大于B放出的能量.说明A得电子的能量强于B,非金属性比B强;氢化物越稳定,则原子得电子能力越强,离子核外电子数相等,离子半径是B>C,可以知道B、C的氧化性强弱关系.据此分析.
解答:解:由题意可知,A、B在反应时各结合一个电子形成稳定结构所放出的能量是B<A,说明A得电子的能量强于B,
所以氧化性是A>B;
由于氢化物的稳定性是HD>HA,
所以氧化性是D>A;
由原子序数C<B,其稳定结构的离子核外电子数相等,而其离子半径是B>C,
则氧化性是B>C.
综上所述,四种元素的非金属性从强到弱排列顺序是D、A、B、C.
所以,A、B、D错误,C正确.
故选:C.
所以氧化性是A>B;
由于氢化物的稳定性是HD>HA,
所以氧化性是D>A;
由原子序数C<B,其稳定结构的离子核外电子数相等,而其离子半径是B>C,
则氧化性是B>C.
综上所述,四种元素的非金属性从强到弱排列顺序是D、A、B、C.
所以,A、B、D错误,C正确.
故选:C.
点评:本题考查学生元素周期律的有关知识,可以根据教材知识来回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
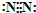
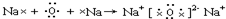
 图A、B是碳元素和氮元素在元素周期表中的部分信息,C、D是两种粒子的结构示意图.仔细观察,按要求回答下列问题:
图A、B是碳元素和氮元素在元素周期表中的部分信息,C、D是两种粒子的结构示意图.仔细观察,按要求回答下列问题: