题目内容
H2跟C和CO一样,具有还原性.加热条件下,使足量H2与铜和氧化铁的混合物18.8g充分反应,冷却后,称量剩余物质的质量为14g.求剩余物中铜元素的质量分数.(请你至少用三种方法求解)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:本题的反应是H2还原Fe2O3,减少的质量是氧的质量,参加反应的氢气与氧反应生成了水,剩余固体为铁和铜的混合物.因此,从不同的角度出发和用不同的方法,便有多种解法.
解答:解:方法1:根据质量守恒定律分析固体减少的质量就是氧化铁中氧元素的质量,设混合物中氧化铁的质量为x.
Fe2O3+3H2
2Fe+3H2O 减少的质量
160 112 48
x 18.8g-14g
=
,
x=16g
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
×100%=20%
答:剩余物中铜元素的质量分数为20%.
方法2.氧化铁中失去氧的质量为:18.8g-14g=4.8g,
它与氢气反应生成水的质量为:48g×
=5.4g
设,原混合物中氧化铁的质量为x,
Fe2O3+3H2
2Fe+3H2O
160 54
x 5.4g
=
x=16g
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
×100%=20%
答:剩余物中铜元素的质量分数为20%.
方法3:利用化学式求解,
氧元素的质量为:18.8g-14g=4.8g,
原混合物中氧化铁的质量为:4.8g×
=16g
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
×100%=20%
答:剩余物中铜元素的质量分数为20%.
Fe2O3+3H2
| ||
160 112 48
x 18.8g-14g
| 160 |
| x |
| 48 |
| 18.8g-14g |
x=16g
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
| 2.8g |
| 14g |
答:剩余物中铜元素的质量分数为20%.
方法2.氧化铁中失去氧的质量为:18.8g-14g=4.8g,
它与氢气反应生成水的质量为:48g×
| 18 |
| 16 |
设,原混合物中氧化铁的质量为x,
Fe2O3+3H2
| ||
160 54
x 5.4g
| 160 |
| x |
| 54 |
| 5.4g |
x=16g
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
| 2.8g |
| 14g |
答:剩余物中铜元素的质量分数为20%.
方法3:利用化学式求解,
氧元素的质量为:18.8g-14g=4.8g,
原混合物中氧化铁的质量为:4.8g×
| 160 |
| 48 |
原混合物中铜的质量=18.8g-16g=2.8g
所以剩余物中铜元素的质量分数=
| 2.8g |
| 14g |
答:剩余物中铜元素的质量分数为20%.
点评:此题主要考查学生根据化学方程式的计算,根据题意找出已知量和待求量的相关数据,根据化学方程式的解题格式进行计算解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制得的能源为二级能源.如氢气属高效、无污染的二级能源,是因为自然界中现成的氢气很少.下列叙述正确的是( )
| A、天然气属一级能源 |
| B、煤属二级能源 |
| C、家用电器使用的电能属一级能源 |
| D、风能属二级能源 |
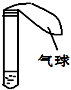 如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球变大的一组物质是( )
如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球变大的一组物质是( )| A、氯化钠和水 |
| B、铜粉和稀硫酸 |
| C、硝酸铵和水 |
| D、氢氧化钠和水 |
下列物质的水溶液pH依次减小的是( )
| A、H2O,H2SO4,NaOH |
| B、Ca(OH)2,H2O,HCl |
| C、H2SO4,H2O,NaOH |
| D、HCl,CaO,H2O |
 如图所示:
如图所示: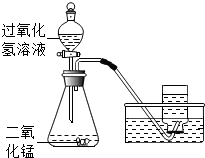 如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表.
如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表.