题目内容
某海洋化工集团用氨碱法生产的纯碱产品中含有少量的氯化钠杂质,其产品包装袋上注明:碳酸钠≥
96%.为判定该产品中含碳酸钠的质量分数,进行如下实验:取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
(1)
第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.(2)
该产品中碳酸钠的质量分数是否合格?(要求精确到0.1%)(3)
根据实验数据,在下边的坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线.(只画出曲线即可)
答案:略
解析:
提示:
解析:
|
(1)1.8 (2) 二氧化碳的质量为:158.0g+100g-253.6g=4.4g设参加反应的碳酸钠质量为 x.
通过计算求得碳酸钠的含量为: 
结论:该产品中碳酸钠的质量分数合格. (3)
|
提示:
|
恰好完全反应时稀盐酸的质量为 61.1g. |

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是 .
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为 ,制取和收集氨气可用下图中的 和 装置.
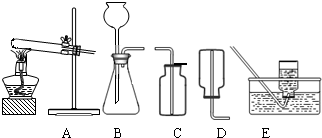
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是 g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.
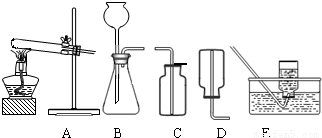
(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(1)碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,它属于
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
请你据此分析计算:
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
______(填“酸”、“碱”或“盐”),它的俗名叫纯碱的原因是______.
(2)无水碳酸钠的工业制法主要有氨碱法和联合制碱法两种.氨碱法即以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气(极易溶于水)为原料来制取纯碱.工业上是用N2和H2在高温、高压和催化剂条件下合成氨的.实验室一般用氯化铵和消石灰共热来制备少量的氨气,该反应的化学方程式为______,制取和收集氨气可用下图中的______和______装置.

(3)某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验,取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及所盛物质的总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
②该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)

