题目内容
【题目】某兴趣小组为测定石灰石中碳酸钙的质量分数,取20克样品,高温煅烧至完全分解,停止加热,称量反应后固体质量为13.4g,假设杂质不反应(CaCO3![]() CaO+ CO2 ↑)
CaO+ CO2 ↑)
(1)反应中生成的二氧化碳质量为______;
(2)碳酸钙的质量分数是_____________?(写出计算过程)
【答案】6.6g 75%
【解析】
根据质量守恒定律,固体质量的减少的质量即为生成的二氧化碳质量;据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出石灰石样品中碳酸钙的质量分数。
(1)根据质量守恒定律,固体质量减少的质量即为生成二氧化碳的质量为:20g-13.4g=6.6g;
(2)设20g石灰石固体样品中含碳酸钙的质量为x,

![]()
x=15g,
石灰石样品中碳酸钙的质量分数是:![]() ×100%=75%。
×100%=75%。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
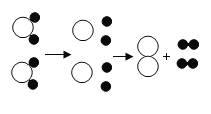
【题目】宏观与微观是认识事物的两种基本角度。可以用“分”与“合”的思想设计实验证明水的组成。

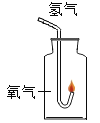
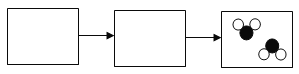
实验装置图 | 微观示意图 | 实验步骤 | 实验现象 | 结论及解释 |
|
| 通直流电。 | 一段时间后,试管a 中气体的体积约为试管 b 中气体的体积的_____倍。 | 水由_____元素组成。 水 分 子 中氢、氧原子的个数比为_____ 。 |
切断电源,取出试管。将燃着的木条伸入试管 a 中; 用带火星的木条伸 入试管 b 中。 | 试管 a 中的气体能燃烧,产生淡蓝色火焰; 试管 b 中的气体使带火星的木条_____。 | |||
|
在方框中画出氢气燃烧的微观示意图。_____ | 点燃氢气,伸入充满氧气的干燥集气瓶中。 | 。_____ |